Реакция Лейкарта — это химическая реакция , которая преобразует альдегиды или кетоны в амины путем восстановительного аминирования в присутствии тепла. [1] [2] Реакция, названная в честь Рудольфа Лейкарта , использует либо формиат аммония , либо формамид в качестве донора азота и восстановителя . [3] Для нее требуются высокие температуры, обычно от 120 до 130 °C; для варианта с формамидом температура может превышать 165 °C. [1]
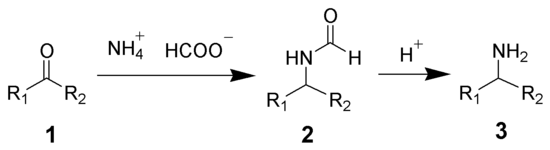
Реакция Лейкарта названа в честь ее разработчика, немецкого химика Рудольфа Лейкарта (1854–1899). Он обнаружил, что нагревание бензальдегида с формамидом не дает бензилидендиформамид, как предполагалось, а бензиламин . [4] В 1891 году коллега Лейкарта из Геттингенского университета Отто Валлах провел дополнительные реакции с использованием алициклических и терпеноидных кетонов, а также альдегидов, продемонстрировав общее применение. [4] В течение прошлого столетия химики открыли несколько методов улучшения выхода реакции и проведения ее в менее напряженных условиях. Поллард и Янг обобщили различные способы, которыми могут быть образованы амины: с использованием либо формамида, либо формиата аммония, или обоих, или добавлением муравьиной кислоты к формамиду. [3] Однако использование только формиата аммония в качестве реагента дает наилучшие выходы. [1] [3] Использование формамида дает низкие выходы по сравнению с формиатом аммония, но выходы можно увеличить, используя большое количество формамида или используя формиат аммония, сульфат аммония и хлорид магния в качестве катализаторов . [5]
Формиат аммония сначала диссоциирует на муравьиную кислоту и аммиак . Затем аммиак осуществляет нуклеофильную атаку на карбонильный углерод. [3] Кислород депротонирует водород из азота, образуя гидроксил. Гидроксил протонируется с использованием водорода из муравьиной кислоты, что позволяет молекуле воды уйти. Это образует карбокатион, который стабилизирован резонансом. Соединение атакует водород из депротонированной муравьиной кислоты с предыдущего шага, образуя диоксид углерода и амин.
Формамид сначала нуклеофильно атакует карбонильный углерод. [3] Кислород протонируется путем отщепления водорода от атома азота, впоследствии образуя молекулу воды, которая уходит, образуя производное N-формила, которое стабилизируется резонансом. [3] Вода гидролизует формамид, образуя формиат аммония, который действует как восстановитель и присоединяется к производному N-формила. Происходит гидридный сдвиг, что приводит к потере диоксида углерода. Добавляется ион аммония, образуя имин и выделяя аммиак. Имин подвергается гидролизу, образуя амин, который изображен на схеме ниже.

Примером реакции Лейкарта является ее использование в синтезе тетрагидро-1,4-бензодиазепин-5-она, молекулы, которая является частью семейства бензодиазепинов . [6] Многие соединения в этом семействе молекул являются подавляющими центральную нервную систему и связаны с терапевтическим применением и различными лекарствами, такими как антибиотики, противоязвенные и анти-ВИЧ агенты. [6] Исследователи синтезировали тетрагидро-1,4-бензодиазепин-5-оны с превосходными выходами и чистотой, используя реакцию Лейкарта. Они провели реакцию посредством твердофазного синтеза и использовали муравьиную кислоту в качестве восстановителя. [6]