В органической химии реакция Нефа — органическая реакция , описывающая кислотный гидролиз соли первичного или вторичного нитроалкана ( R-NO 2 ) до альдегида ( R-CH=O ) или кетона ( R 2 C=O ) . и закись азота ( N 2 O ). Реакция была предметом нескольких обзоров литературы. [1] [2] [3]

О реакции сообщил в 1894 году химик Джон Ульрик Неф [4] , который обработал натриевую соль нитроэтана серной кислотой, что привело к выходу 85–89% закиси азота и по меньшей мере 70% выхода ацетальдегида . Однако годом ранее, в 1893 г., реакция была впервые проведена Коноваловым [5] , который превратил калиевую соль 1-фенилнитроэтана серной кислотой в ацетофенон .
Механизм реакции , начинающийся с нитронатной соли в виде резонансных структур 1a и 1b , изображен ниже:
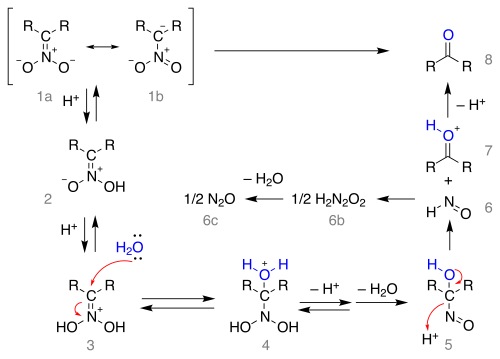
Соль протонируется с образованием нитроновой кислоты 2 (в некоторых случаях эти нитронаты были выделены) и еще раз до иминиевого иона 3 . Это промежуточное соединение подвергается воздействию воды в результате нуклеофильного присоединения, образуя соединение 4 , которое теряет протон, а затем воду с образованием 1- нитрозоалканола 5 , который, как полагают, ответственен за темно-синий цвет реакционной смеси во многих реакциях Нефа. Это промежуточное соединение перегруппировывается в гипоазотистую кислоту 6 (образуя закись азота 6c - 6b ) и ион оксония 7 , который теряет протон с образованием карбонильного соединения.
Обратите внимание, что для образования нитронатной соли из нитросоединения требуется альфа-атом водорода , и поэтому реакция с третичными нитросоединениями невозможна.
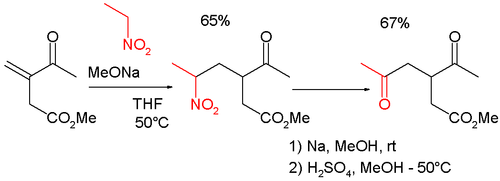
Реакции типа Нефа часто встречаются в органическом синтезе , поскольку они превращают реакцию Генри в удобный метод функционализации в положениях β и γ. [6] Так, например, реакция сочетается с реакцией Михаэля при синтезе γ -кето-карбонилметил-3-ацетил-5-оксогексаноата, который сам является промежуточным циклопентеноном : [7] [8]
В химии углеводов они представляют собой метод удлинения цепи альдоз , как при изотопном мечении C 14 - D ‑ маннозы и C 14 - D ‑ глюкозы из D ‑ арабинозы и C 14 ‑ нитрометана (первый шаг здесь — метод Генри реакция ):

Противоположная реакция – деградация Воля .
Первоначальный протокол Нефа с использованием концентрированной серной кислоты был описан как «жестокий». [9] Сильнокислотный гидролиз без промежуточной стадии соли приводит к образованию карбоновых кислот и солей гидроксиламина , [ нужна ссылка ] , но кислоты Льюиса, такие как хлорид олова (IV) [10] и хлорид железа (III) [11] дают чистый гидролиз. Альтернативно, сильные окислители , такие как оксон , [12] озон или перманганаты , расщепляют нитронатный таутомер по двойной связи с образованием карбонила и нитрата . Оксофильные восстановители, такие как соли титана , восстанавливают нитронат до гидролизуемого имина , но менее селективные восстановители вместо этого дают амин. [9]