Реакция конверсии водяного газа (WGSR) описывает реакцию оксида углерода и водяного пара с образованием диоксида углерода и водорода :
Реакция конверсии водяного газа была открыта итальянским физиком Феличе Фонтана в 1780 году. Промышленное значение этой реакции было осознано гораздо позже. До начала 20-го века водород получали путем реакции пара под высоким давлением с железом для получения оксида железа и водорода. С развитием промышленных процессов, требующих водорода, таких как синтез аммиака Габера-Боша , потребовался менее дорогой и более эффективный метод производства водорода . Для решения этой проблемы WGSR был объединен с газификацией угля для получения водорода.
WGSR — это очень ценная промышленная реакция, которая используется в производстве аммиака, углеводородов , метанола и водорода . Ее наиболее важное применение связано с конверсией оксида углерода из парового риформинга метана или других углеводородов при производстве водорода. [1] В процессе Фишера-Тропша WGSR — одна из важнейших реакций, используемых для балансировки соотношения H2 / CO. Она обеспечивает источник водорода за счет оксида углерода, что важно для производства водорода высокой чистоты для использования в синтезе аммиака.
Реакция конверсии вода-газ может быть нежелательной побочной реакцией в процессах, включающих воду и оксид углерода, например, в процессе Monsanto на основе родия. Процесс Cativa на основе иридия использует меньше воды, что подавляет эту реакцию.
WGSR может помочь в повышении эффективности топливных элементов за счет увеличения производства водорода. WGSR считается критически важным компонентом в снижении концентрации оксида углерода в элементах, которые восприимчивы к отравлению оксидом углерода, таких как топливный элемент с протонообменной мембраной (PEM) . [2] Преимущества этого применения двояки: реакция конверсии водяного газа не только эффективно снижает концентрацию оксида углерода, но и повышает эффективность топливных элементов за счет увеличения производства водорода. [2] К сожалению, текущие коммерческие катализаторы, которые используются в промышленных процессах конверсии водяного газа, несовместимы с приложениями топливных элементов. [3] Учитывая высокий спрос на чистое топливо и решающую роль реакции конверсии водяного газа в водородных топливных элементах, разработка катализаторов конверсии водяного газа для применения в технологии топливных элементов является областью текущего исследовательского интереса.
Катализаторы для применения в топливных элементах должны работать при низких температурах. Поскольку WGSR медленный при более низких температурах, где равновесие благоприятствует производству водорода, реакторы WGS требуют большого количества катализаторов, что увеличивает их стоимость и размер за пределами практического применения. [2] Коммерческий катализатор LTS, используемый на крупных промышленных предприятиях, также является пирофорным в неактивном состоянии и, следовательно, представляет проблемы безопасности для потребительских применений. [3] Разработка катализатора, который может преодолеть эти ограничения, имеет отношение к внедрению водородной экономики.
Реакция WGS используется в сочетании с твердой адсорбцией CO2 в процессе конверсии водяного газа с улучшенной сорбцией ( SEWGS) для получения потока водорода высокого давления из синтез-газа . [4]
Равновесие этой реакции существенно зависит от температуры, а константа равновесия уменьшается с ростом температуры, то есть при более низких температурах наблюдается более высокое образование водорода.

С ростом температуры скорость реакции увеличивается, но производство водорода становится менее выгодным термодинамически [5] , поскольку реакция конверсии водяного газа является умеренно экзотермической ; этот сдвиг химического равновесия можно объяснить в соответствии с принципом Ле Шателье . В диапазоне температур 600–2000 К константа равновесия для WGSR имеет следующее соотношение: [3]
Чтобы воспользоваться преимуществами как термодинамики , так и кинетики реакции, реакция конверсии водяного газа в промышленных масштабах проводится в несколько адиабатических стадий, состоящих из высокотемпературной конверсии (HTS), за которой следует низкотемпературная конверсия (LTS) с межсистемным охлаждением. [6] Первоначальная HTS использует преимущества высоких скоростей реакции, но приводит к неполной конверсии оксида углерода. Последующий реактор низкотемпературной конверсии снижает содержание оксида углерода до <1%. Коммерческие катализаторы HTS основаны на оксиде железа - оксиде хрома , а катализатор LTS - на основе меди. Медный катализатор подвержен отравлению серой . Соединения серы удаляются перед реактором LTS с помощью защитного слоя. Важным ограничением для HTS является соотношение H 2 O/CO, где низкие соотношения могут привести к побочным реакциям, таким как образование металлического железа, метанирование , осаждение углерода и реакция Фишера-Тропша.
Типичный состав коммерческого катализатора HTS, как сообщается, составляет 74,2% Fe 2 O 3 , 10,0% Cr 2 O 3 , 0,2% MgO (остальной процент приписывается летучим компонентам). [7] Хром действует для стабилизации оксида железа и предотвращает спекание . Работа катализаторов HTS происходит в диапазоне температур от 310 °C до 450 °C. Температура увеличивается по длине реактора из-за экзотермической природы реакции. Таким образом, температура на входе поддерживается на уровне 350 °C, чтобы предотвратить превышение температуры на выходе 550 °C. Промышленные реакторы работают в диапазоне от атмосферного давления до 8375 кПа (82,7 атм). [7] Поиск высокопроизводительных катализаторов HT WGS остается интенсивной темой исследований в области химии и материаловедения. Энергия активации является ключевым критерием для оценки каталитической эффективности в реакциях WGS. На сегодняшний день некоторые из самых низких значений энергии активации были обнаружены для катализаторов, состоящих из наночастиц меди на носителях из оксида церия [8] , при этом сообщалось о таких низких значениях, как Ea = 34 кДж/моль относительно генерации водорода.
Катализаторы для низкотемпературной реакции WGS обычно основаны на керамических фазах, загруженных медью или оксидом меди. В то время как наиболее распространенные носители включают оксид алюминия или оксид алюминия с оксидом цинка, другие носители могут включать оксиды редкоземельных металлов, шпинели или перовскиты. [9] Сообщается, что типичный состав коммерческого катализатора LTS составляет 32-33% CuO, 34-53% ZnO, 15-33% Al 2 O 3 . [3] Активным каталитическим видом является CuO. Функция ZnO заключается в обеспечении структурной поддержки, а также в предотвращении отравления меди серой. Al 2 O 3 предотвращает дисперсию и усадку гранул. Реактор сдвига LTS работает в диапазоне 200–250 °C. Верхний температурный предел обусловлен восприимчивостью меди к термическому спеканию. Эти более низкие температуры также уменьшают возникновение побочных реакций, которые наблюдаются в случае HTS. Для LTS также использовались благородные металлы, такие как платина, на основе церия. [10]
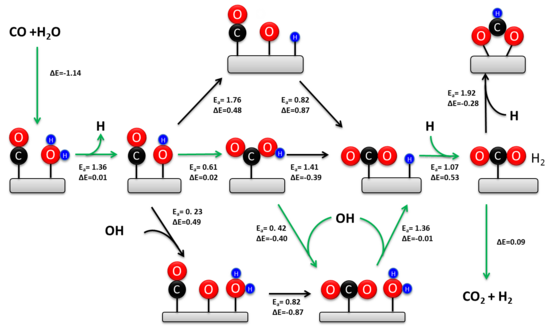
WGSR широко изучался более ста лет. Кинетически релевантный механизм зависит от состава катализатора и температуры. [6] [14] Было предложено два механизма: ассоциативный механизм Ленгмюра-Хиншельвуда и окислительно-восстановительный механизм. Окислительно-восстановительный механизм обычно рассматривается как кинетически релевантный во время высокотемпературного WGSR (> 350 °C) по сравнению с промышленным железохромовым катализатором. [5] Исторически сложилось так, что вокруг механизма было гораздо больше споров при низких температурах. Недавние экспериментальные исследования подтверждают, что ассоциативный карбоксильный механизм является преобладающим низкотемпературным путем на катализаторах переходных металлов на основе оксида металла. [15] [13]
В 1920 году Армстронг и Хилдич впервые предложили ассоциативный механизм. В этом механизме CO и H 2 O адсорбируются на поверхности катализатора, после чего происходит образование промежуточного продукта и десорбция H 2 и CO 2 . В общем случае H 2 O диссоциирует на катализаторе, образуя адсорбированные OH и H. Диссоциированная вода реагирует с CO, образуя карбоксильный или формиатный промежуточный продукт. Затем промежуточный продукт дегидрируется, образуя CO 2 и адсорбированный H. Два адсорбированных атома H рекомбинируют, образуя H 2 .
Имели место значительные разногласия относительно кинетически значимого промежуточного продукта в ассоциативном механизме. Экспериментальные исследования показывают, что оба промежуточных продукта вносят вклад в скорость реакции на катализаторах переходных металлов на основе оксида металла. [15] [13] Однако карбоксильный путь составляет около 90% от общей скорости из-за термодинамической стабильности адсорбированного формиата на оксидном носителе. Активный центр для образования карбоксила состоит из атома металла, соседствующего с адсорбированным гидроксилом. Этот ансамбль легко образуется на границе раздела металл-оксид и объясняет гораздо более высокую активность переходных металлов на основе оксида по сравнению с протяженными металлическими поверхностями. [13] Частота оборота для WGSR пропорциональна константе равновесия образования гидроксила, что объясняет, почему восстанавливаемые оксидные носители (например, CeO 2 ) более активны, чем невосстанавливаемые носители (например, SiO 2 ) и протяженные металлические поверхности (например, Pt). В отличие от активного центра для образования карбоксила, образование формиата происходит на протяженных металлических поверхностях. Промежуточный формиат может быть устранен в ходе WGSR с помощью катализаторов на основе атомно-дисперсных переходных металлов на оксидной подложке, что еще раз подтверждает кинетическое доминирование карбоксильного пути. [16]
Механизм окисления-восстановления включает изменение степени окисления каталитического материала. В этом механизме CO окисляется атомом O, внутренне принадлежащим каталитическому материалу, с образованием CO 2 . Молекула воды подвергается диссоциативной адсорбции на вновь образованной вакансии O с образованием двух гидроксилов. Гидроксилы диспропорционируют с образованием H 2 и возвращают каталитическую поверхность в ее предреакционное состояние.
Механизм включает нуклеофильную атаку воды или гидроксида на центр M-CO, в результате чего образуется металлакарбоновая кислота . [2] [17]
WGSR является экзергоническим и имеет следующие термодинамические параметры при комнатной температуре (298 К):
В водном растворе реакция менее экзергоническая. [18]
При преобразовании диоксида углерода в полезные материалы реакция конверсии воды в газ используется для получения оксида углерода из водорода и диоксида углерода. Иногда это называют обратной реакцией конверсии воды в газ . [19]
Водяной газ определяется как топливный газ, состоящий в основном из оксида углерода (CO) и водорода (H 2 ). Термин «сдвиг» в термине «сдвиг воды в газ» означает изменение соотношения состава водяного газа (CO:H 2 ). Соотношение может быть увеличено путем добавления CO 2 или уменьшено путем добавления пара в реактор.