В кардиологии ремоделирование желудочков (или ремоделирование сердца ) [1] относится к изменениям размера, формы, структуры и функции сердца . Это может произойти в результате физических упражнений (физиологическое ремоделирование) или после повреждения сердечной мышцы (патологическое ремоделирование). [2] Травма обычно возникает в результате острого инфаркта миокарда (обычно трансмурального инфаркта или инфаркта с подъемом сегмента ST), но может быть вызвана рядом причин, которые приводят к увеличению давления или объема , вызывая перегрузку давлением или перегрузку объемом (формы напряжения) на сердце. Хроническая гипертония , врожденные пороки сердца с внутрисердечным шунтированием и пороки клапанов сердца также могут привести к ремоделированию. После возникновения инсульта в миокарде левого желудочка происходит ряд гистопатологических и структурных изменений, которые приводят к прогрессирующему снижению работоспособности левого желудочка. В конечном итоге ремоделирование желудочков может привести к снижению сократительной ( систолической ) функции и уменьшению ударного объема .
Физиологическое ремоделирование обратимо, тогда как патологическое ремоделирование в большинстве случаев необратимо. Ремоделирование желудочков под давлением левого/правого давления делает несоответствия неизбежными. Патологические несоответствия давления между легочным и большим кругами кровообращения приводят к компенсаторному ремоделированию левого и правого желудочков. Термин «обратное ремоделирование» в кардиологии подразумевает улучшение механики и функции желудочков после отдаленной травмы или патологического процесса. [3] [4] [5]
Ремоделирование желудочков может включать гипертрофию желудочков , дилатацию желудочков , кардиомегалию и другие изменения. Это аспект кардиомиопатии , которой существует множество типов. Концентрическая гипертрофия возникает из-за перегрузки давлением , а эксцентрическая гипертрофия - из-за перегрузки объемом . [6]
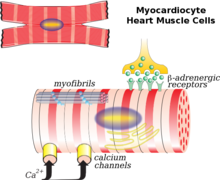
Кардиомиоцит является основной клеткой, участвующей в ремоделировании . Фибробласты , коллаген , интерстиций и в меньшей степени коронарные сосуды также играют роль. Распространенный сценарий ремоделирования – после инфаркта миокарда. Наблюдается некроз миокарда (гибель клеток) и непропорциональное истончение сердца. Эта тонкая, ослабленная область не способна выдерживать давление и объемную нагрузку на сердце так же, как другие здоровые ткани. В результате происходит расширение камеры, исходящей из области инфаркта. Начальная фаза ремоделирования после инфаркта миокарда приводит к восстановлению некротической области и рубцеванию миокарда , что в некоторой степени можно считать полезным, поскольку происходит улучшение или поддержание функции ЛЖ и сердечного выброса . Однако со временем, когда сердце претерпевает постоянную ремоделацию, оно становится менее эллиптическим и более сферическим. Масса и объем желудочков увеличиваются, что в совокупности отрицательно влияет на функцию сердца. В конце концов, диастолическая функция или способность сердца расслабляться между сокращениями может ухудшиться, что приведет к дальнейшему ухудшению состояния. [7]
После инфаркта миокарда (ИМ) гибель сердечных миоцитов может быть вызвана некрозом , апоптозом или аутофагией , что приводит к истончению сердечной стенки. [8] Выжившие кардиальные миоциты располагаются либо параллельно, либо последовательно друг к другу, способствуя дилатации или гипертрофии желудочков, в зависимости от нагрузки на стенку желудочка. [7] Кроме того, считается, что снижение экспрессии миозина V1 и кальциевых каналов L-типа на кардиомиоцитах также вызывает ремоделирование сердца. В нормальных условиях организма жирные кислоты обеспечивают от 60 до 90% энергетического обеспечения сердца. После ИМ, поскольку окисление жирных кислот уменьшается, это приводит к снижению энергообеспечения кардиомиоцитов, накоплению жирных кислот до токсических уровней и дисфункции митохондрий . Эти последствия также привели к усилению окислительного стресса в сердце, вызывая пролиферацию фибробластов , активацию металлопротеиназ и индукцию апоптоза, что будет объяснено ниже. Кроме того, указанным изменениям способствует воспалительный иммунный ответ после ИМ. [8]
Кроме того, сердечный интерстиций, состоящий в основном из коллагеновых волокон типа I и типа III, также участвует в ремоделировании сердца. Сердечный коллаген синтезируется фибробластами и расщепляется металлопротеиназами. [7] Фибробласты активируются после ИМ, что приводит к увеличению синтеза коллагена и фиброзу сердца. [8] Увеличение экспрессии MMP1 и MMP9 привело к деградации коллагеновых волокон и последующему расширению сердца. [7] Известно , что несколько сигнальных путей, таких как ангиотензин II , трансформирующий фактор роста бета (TGF-бета) и эндотелин 1, запускают синтез и деградацию коллагеновых волокон в сердце. [8]
Другие факторы, такие как высокое кровяное давление, активация симпатической системы, которая высвобождает норадреналин , активация ренин-ангиотензиновой системы , которая высвобождает ренин и антидиуретические гормоны, вносят важный вклад в ремоделирование сердца. Однако считается, что предсердный натрийуретический пептид оказывает кардиозащитное действие. [7]
Ремоделирование сердца оценивается с помощью эхокардиограммы . С помощью этого теста можно охарактеризовать размер и функцию предсердий и желудочков. [ нужна цитата ]
На ход и степень ремоделирования влияют многие факторы, включая тяжесть повреждения, вторичные события (рецидивирующая ишемия или инфаркт), нейрогормональную активацию, генетические факторы и экспрессию генов , а также лечение. Лекарства могут ослабить ремоделирование. На животных моделях было показано , что ингибиторы ангиотензинпревращающего фермента (АПФ) уменьшают ремоделирование или трансмуральный инфаркт и хроническую перегрузку давлением. Клинические исследования показали, что терапия ингибиторами АПФ после инфаркта миокарда приводит к улучшению работоспособности миокарда, улучшению фракции выброса и снижению смертности по сравнению с пациентами, получавшими плацебо. Аналогично, ингибирование альдостерона , прямо или косвенно, приводит к улучшению ремоделирования. [9] Карведилол , бета-блокатор 3-го поколения , может фактически обратить вспять процесс ремоделирования, уменьшая объемы левого желудочка и улучшая систолическую функцию. [10] [11] Сердечная ресинхронизирующая терапия (СРТ) продемонстрировала способность обратить вспять ремоделирование левого желудочка у некоторых пациентов. [12] [13] Ранняя коррекция врожденных пороков сердца, если это необходимо, может предотвратить ремоделирование, как и лечение хронической гипертонии или пороков клапанов сердца . Часто также наблюдается обратное ремоделирование или улучшение функции левого желудочка. [ нужна цитата ]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )