| Refresh | This website ru.stringtranslate.com/%D1%81%D0%B2%D1%8F%D0%B7%D0%B0%D0%BD%D0%BD%D0%BE%D0%B9/Methyltransferase is currently offline. Cloudflare's Always Online™ shows a snapshot of this web page from the Internet Archive's Wayback Machine. To check for the live version, click Refresh. |


Метилтрансферазы — это большая группа ферментов, которые метилируют свои субстраты, но могут быть разделены на несколько подклассов на основе их структурных особенностей. Наиболее распространенным классом метилтрансфераз является класс I, все из которых содержат складку Россмана для связывания S -аденозилметионина (SAM). Метилтрансферазы класса II содержат домен SET, примером которого являются гистоновые метилтрансферазы с доменом SET , и метилтрансферазы класса III, которые связаны с мембраной. [1] Метилтрансферазы также можно сгруппировать как различные типы, использующие различные субстраты в реакциях переноса метильной группы. Эти типы включают белковые метилтрансферазы, ДНК/РНК метилтрансферазы, метилтрансферазы природных продуктов и независимые от SAM метилтрансферазы. SAM является классическим донором метильной группы для метилтрансфераз, однако в природе встречаются примеры других доноров метильной группы. Общий механизм переноса метильной группы представляет собой нуклеофильную атаку типа S N 2 , где сера метионина служит в качестве уходящей группы, а метильная группа, присоединенная к ней, действует как электрофил , который переносит метильную группу на субстрат фермента. В ходе этого процесса SAM превращается в S -аденозилгомоцистеин (SAH). Разрыв связи SAM-метил и образование связи субстрат-метил происходят почти одновременно. Эти ферментативные реакции встречаются во многих путях и связаны с генетическими заболеваниями, раком и метаболическими заболеваниями. Другим типом переноса метильной группы является радикальный S-аденозилметионин (SAM), который представляет собой метилирование неактивированных атомов углерода в первичных метаболитах, белках, липидах и РНК.
Метилирование, как и другие эпигенетические модификации, влияет на транскрипцию , стабильность генов и родительский импринтинг . [2] Оно напрямую влияет на структуру хроматина и может модулировать транскрипцию генов или даже полностью заглушать или активировать гены без мутации самого гена. Хотя механизмы этого генетического контроля сложны, гипо- и гиперметилирование ДНК вовлечено во многие заболевания.
Метилирование белков играет регуляторную роль во взаимодействиях белок-белок , белок-ДНК и активации белков.
Примеры: RCC1, важный митотический белок, метилирован, чтобы взаимодействовать с центромерами хромосом. Это пример регуляции взаимодействия белок-белок, поскольку метилирование регулирует присоединение RCC1 к гистоновым белкам H2A и H2B . Взаимодействие RCC1-хроматин также является примером взаимодействия белок-ДНК, поскольку другой домен RCC1 напрямую взаимодействует с ДНК, когда этот белок метилирован. Когда RCC1 не метилирован, делящиеся клетки имеют несколько полюсов веретена и обычно не могут выжить.
p53 метилирован на лизине для регулирования его активации и взаимодействия с другими белками в ответе на повреждение ДНК. Это пример регуляции белок-белковых взаимодействий и активации белка. p53 — известный супрессор опухолей , который активирует пути восстановления ДНК , инициирует апоптоз и останавливает клеточный цикл . В целом, он реагирует на мутации в ДНК, сигнализируя клетке исправить их или инициировать гибель клетки, чтобы эти мутации не могли способствовать развитию рака.
NF-κB (белок, участвующий в воспалении) является известной мишенью метилирования метилтрансферазы SETD6 , которая отключает сигнализацию NF-κB путем ингибирования одной из ее субъединиц, RelA . Это снижает транскрипционную активацию и воспалительный ответ , делая метилирование NF-κB регуляторным процессом, посредством которого снижается клеточная сигнализация через этот путь. [3]
Метилтрансферазы природного продукта обеспечивают разнообразные входы в метаболические пути, включая доступность кофакторов, сигнальных молекул и метаболитов. Это регулирует различные клеточные пути, контролируя активность белков.
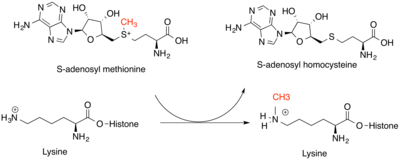
Гистонметилтрансферазы имеют решающее значение для генетической регуляции на эпигенетическом уровне. Они модифицируют в основном лизин на ε-азотном ε-атоме и аргинин -гуанидиновую группу на хвостах гистонов. Лизинметилтрансферазы и аргининметилтрансферазы являются уникальными классами ферментов, но обе связывают SAM в качестве донора метильной группы для своих гистоновых субстратов. Аминокислоты лизина могут быть модифицированы одной, двумя или тремя метильными группами, в то время как аминокислоты аргинина могут быть модифицированы одной или двумя метильными группами. Это увеличивает силу положительного заряда и гидрофобность остатка , позволяя другим белкам распознавать метильные метки. Эффект этой модификации зависит от местоположения модификации на хвосте гистонов и других модификаций гистонов вокруг него. Местоположение модификаций может быть частично определено последовательностью ДНК, а также малыми некодирующими РНК и метилированием самой ДНК. Чаще всего у позвоночных метилируется гистон H3 или H4. Может происходить как повышенная, так и пониженная транскрипция генов вокруг модификации. Повышенная транскрипция является результатом пониженной конденсации хроматина , в то время как пониженная транскрипция является результатом повышенной конденсации хроматина. [4] Метильные метки на гистонах способствуют этим изменениям, выступая в качестве участков для привлечения других белков, которые могут дополнительно модифицировать хроматин. [5]

N-альфа-метилтрансферазы переносят метильную группу с SAM на N-концевой азот на белковых мишенях. N-концевой метионин сначала расщепляется другим ферментом, а консенсусная последовательность X- пролин -лизин распознается метилтрансферазой. Для всех известных субстратов аминокислота X - это аланин , серин или пролин. Эта реакция дает метилированный белок и SAH. Известные мишени этих метилтрансфераз у людей включают RCC-1 (регулятор ядерных транспортных белков) и белок ретинобластомы (белок-супрессор опухолей, который ингибирует чрезмерное деление клеток). Метилирование RCC-1 особенно важно в митозе , поскольку оно координирует локализацию некоторых ядерных белков при отсутствии ядерной оболочки . Когда RCC-1 не метилирован, деление клеток происходит ненормально из-за образования дополнительных полюсов веретена . [6] Функция N-концевого метилирования белка ретинобластомы неизвестна.

Метилирование ДНК, ключевой компонент генетической регуляции, происходит в первую очередь на 5-углероде основания цитозина , образуя 5'метилцитозин (см. слева). [7] Метилирование является эпигенетической модификацией, катализируемой ферментами ДНК-метилтрансферазами , включая DNMT1, DNMT2 (переименованный в TRDMT1, чтобы отразить его функцию метилирования тРНК, а не ДНК) и DNMT3. Эти ферменты используют S-аденозилметионин в качестве донора метильной группы и содержат несколько высококонсервативных структурных особенностей между тремя формами; к ним относятся сайт связывания S-аденозилметионина, вицинальная пара пролин-цистеин, которая образует тиолатный анион, важный для механизма реакции, и карман связывания цитозинового субстрата. Многие особенности ДНК-метилтрансфераз высококонсервативны во многих классах жизни, от бактерий до млекопитающих. Помимо контроля экспрессии определенных генов , существует множество белковых комплексов, многие из которых имеют значение для здоровья человека, которые связываются только с метилированными сайтами распознавания ДНК . Многие из ранних ДНК-метилтрансфераз, как считалось, произошли от РНК-метилтрансфераз, которые, как предполагалось, были активны в мире РНК для защиты многих видов примитивной РНК. [8] Метилирование РНК наблюдалось в различных типах видов РНК, а именно: мРНК , рРНК , тРНК , мякРНК , мяРНК , микроРНК , тмРНК , а также в видах вирусной РНК. Специфические РНК-метилтрансферазы используются клетками для их маркировки на видах РНК в соответствии с необходимостью и окружающей средой, преобладающей вокруг клеток, что составляет часть области, называемой молекулярной эпигенетикой . 2'-O-метилирование , метилирование m6A , метилирование m1G, а также m5C являются наиболее распространенными метками метилирования, наблюдаемыми в различных типах РНК.
6А — это фермент, который катализирует следующую химическую реакцию: [9]
S-аденозил-L-метионин + ДНК аденин S-аденозил-L-гомоцистеин + ДНК 6-метиламинопурин
m6A был обнаружен в основном у прокариот до 2015 года, когда он был также обнаружен у некоторых эукариот. Метилтрансферазы m6A метилируют аминогруппу в ДНК в положении C-6 специально для того, чтобы не дать системе хозяина переварить собственный геном с помощью рестриктаз. [10]
m5C играет роль в регуляции транскрипции генов. Трансферазы m5C — это ферменты, которые производят C5-метилцитозин в ДНК в положении C-5 цитозина и встречаются у большинства растений и некоторых эукариот. [11]

Метилтрансферазы природных продуктов (NPMT) представляют собой разнообразную группу ферментов, которые добавляют метильные группы к естественным малым молекулам. Как и многие метилтрансферазы, SAM используется в качестве донора метильной группы, а SAH образуется. Метильные группы добавляются к атомам S, N, O или C и классифицируются по тому, какие из этих атомов модифицированы, причем O-метилтрансферазы представляют собой самый большой класс. Метилированные продукты этих реакций выполняют различные функции, включая кофакторы, пигменты, сигнальные соединения и метаболиты. NPMT могут выполнять регуляторную роль, изменяя реакционную способность и доступность этих соединений. Эти ферменты не являются высококонсервативными у разных видов, поскольку они выполняют более специфическую функцию, предоставляя малые молекулы для специализированных путей у видов или небольших групп видов. Отражением этого разнообразия является разнообразие каталитических стратегий, включая общий кислотно-основной катализ , катализ на основе металлов, а также эффекты близости и десольватации, не требующие каталитических аминокислот. НПМТ представляют собой наиболее функционально разнообразный класс метилтрансфераз. [12]

Важные примеры этого класса ферментов у людей включают фенилэтаноламин N-метилтрансферазу (PNMT), которая преобразует норадреналин в адреналин , [14] и гистамин N-метилтрансферазу (HNMT), которая метилирует гистамин в процессе метаболизма гистамина. [15] Катехол- O -метилтрансфераза (COMT) расщепляет класс молекул, известных как катехоламины , который включает дофамин , адреналин и норадреналин. [16]
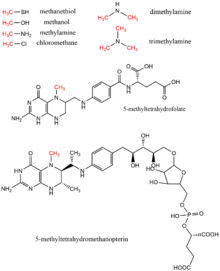
Метанол , метилтетрагидрофолат , моно- , ди- и триметиламин , метантиол , метилтетрагидрометаноптерин и хлорметан — все это доноры метильной группы, которые встречаются в биологии в качестве доноров метильной группы, как правило, в ферментативных реакциях с использованием кофактора витамина B12 . [17] Эти субстраты способствуют путям переноса метильной группы, включая биосинтез метионина , метаногенез и ацетогенез .
На основе различных структур белков и механизмов катализа выделяют 3 различных типа радикальных метилаз SAM (RS): класс A, B и C. Метилазы класса A RS лучше всего охарактеризованы из 4 ферментов и связаны как с RlmN, так и с Cfr. RlmN повсеместно встречается в бактериях, что повышает точность трансляции, а RlmN катализирует метилирование C2 аденозина 2503 (A2503) в 23 S рРНК и C2 аденозина (A37). Cfr, с другой стороны, катализирует метилирование C8 A2503, а также метилирование C2. [18] Класс B в настоящее время является крупнейшим классом радикальных метилаз SAM, которые могут метилировать как sp 2-гибридизованные, так и sp 3-гибридизованные атомы углерода в различных наборах субстратов в отличие от класса A, который катализирует только sp 2-гибридизованные атомы углерода. Главное отличие, которое отличает класс B от других, заключается в дополнительном N-концевом домене связывания кобаламина, который связывается с доменом RS. [19] Метилаза класса C имеет гомологичную последовательность с ферментом RS, копропорфириноген III оксидазой (HemN), которая также катализирует метилирование sp 2-гибридизованных углеродных центров, но в ней отсутствуют 2 цистеина, необходимые для метилирования в механизме класса A. [18]
Как и в случае с любым биологическим процессом, который регулирует экспрессию и/или функцию генов, аномальное метилирование ДНК связано с генетическими нарушениями, такими как ICF , синдром Ретта и синдром ломкой X-хромосомы . [2] Раковые клетки обычно демонстрируют меньшую активность метилирования ДНК в целом, хотя часто наблюдается гиперметилирование в участках, которые не метилированы в нормальных клетках; это избыточное метилирование часто функционирует как способ инактивации генов-супрессоров опухолей . Ингибирование общей активности ДНК-метилтрансферазы было предложено в качестве варианта лечения, но было обнаружено, что ингибиторы DNMT, аналоги их цитозиновых субстратов, являются высокотоксичными из-за их сходства с цитозином (см. справа); это сходство с нуклеотидом приводит к включению ингибитора в трансляцию ДНК , что приводит к синтезу нефункционирующей ДНК.
Метилаза, которая изменяет сайт связывания рибосомальной РНК антибиотика линезолида, вызывает перекрестную резистентность к другим антибиотикам, которые действуют на рибосомальную РНК. Плазмидные векторы, способные передавать этот ген, являются причиной потенциально опасной перекрестной резистентности. [20]
Примеры ферментов метилтрансферазы, имеющих отношение к заболеваниям:
Недавние исследования показали, что метилтрансферазы, участвующие в метилировании природных противораковых агентов, используют аналоги S-аденозилметионина (SAM), которые несут альтернативные алкильные группы в качестве замены метила. Разработка простой хемоферментативной платформы для создания и использования дифференциально алкилированных аналогов SAM в контексте открытия и разработки лекарств известна как алкилрандомизация. [21]
В клетках человека было обнаружено, что m5C был связан с аномальными опухолевыми клетками при раке. [22] Роль и потенциальное применение m5C включают в себя балансировку поврежденной ДНК при раке как гиперметилированием, так и гипометилированием. Эпигенетическое восстановление ДНК может быть применено путем изменения количества m5C в обоих типах раковых клеток (гиперметилирование/гипометилирование), а также окружающей среды раковых клеток для достижения эквивалентной точки для ингибирования опухолевых клеток. [23]
Вот несколько примеров: