
В кремнийорганической химии силоксан представляет собой органическое соединение , содержащее функциональную группу из двух атомов кремния , связанных с атомом кислорода : Si-O-Si . Исходные силоксаны включают олигомерные и полимерные гидриды с формулами H[OSiH 2 ] n OH и [OSiH 2 ] n . [1] Силоксаны также включают разветвленные соединения , определяющей особенностью которых является то, что каждая пара кремниевых центров разделена одним атомом кислорода. Силоксановая функциональная группа образует основу силиконов [-R 2 Si-O-SiR 2 - ] n , основным примером которых является полидиметилсилоксан (ПДМС). [2] Функциональная группа R 3 SiO- (где три R могут быть разными) называется силокси . Силоксаны являются искусственными и имеют множество коммерческих и промышленных применений из-за гидрофобности соединений , низкой теплопроводности и высокой гибкости.
Силоксаны обычно принимают структуры, ожидаемые для связанных тетраэдрических (« sp 3 -подобных») центров. Длина связи Si-O составляет 1,64 Å (по сравнению с расстоянием Si-C 1,92 Å), а угол Si-O-Si довольно открыт и составляет 142,5 °. [3] Напротив, расстояние C-O в типичном диалкиловом эфире намного короче и составляет 1,414 (2) Å с более острым углом C-O-C, равным 111 °. [4] Понятно, что силоксаны будут иметь низкие барьеры для вращения вокруг связей Si-O вследствие низких стерических затруднений. Это геометрическое соображение лежит в основе полезных свойств некоторых силоксансодержащих материалов, таких как их низкие температуры стеклования .

Основной путь получения силоксановой функциональной группы — гидролиз хлоридов кремния :
Реакция протекает через начальное образование силанолов (R 3 Si−OH):
Затем силоксановая связь может образовываться по пути силанол + силанол или по пути силанол + хлорсилан:
Гидролиз силилдихлорида может давать линейные или циклические продукты. Линейные продукты имеют концевые силанольные группы:
Циклические продукты не имеют силанольных концов:
Линейные продукты — полидиметилсилоксан (ПДМС) — имеют большую коммерческую ценность. Для их производства необходимо производство диметилкремния дихлорида .
Начиная с трисиланолов, возможны клетки, такие как виды с формулой (RSi) n O 3 n /2 с кубической ( n = 8) и гексагонально-призматической ( n = 12) структурами. Кубические клетки представляют собой кластеры кубанского типа с кремниевыми центрами в углах куба, кислородными центрами, охватывающими каждый из двенадцати ребер. [6]
Окисление кремнийорганических соединений, в том числе силоксанов, дает диоксид кремния . Это превращение иллюстрируется горением гексаметилциклотрисилоксана :
Сильное основание разрушает силоксановую группу, часто образуя силоксидные соли :
Эта реакция протекает с образованием силанолов. Подобные реакции используются в промышленности для превращения циклических силоксанов в линейные полимеры. [2]
Полисилоксаны (силиконы) при горении в инертной атмосфере обычно подвергаются пиролизу с образованием оксикарбида кремния или карбида кремния (SiC). Используя эту реакцию, полисилоксаны стали использовать в качестве прекерамических полимеров в различных процессах, включая аддитивное производство. Поливинилсилоксан (винилполисилоксан) используется для изготовления зубных и промышленных оттисков. Использование предшественника полисилоксана в керамике на основе полимеров позволяет формировать керамические тела сложной формы, хотя необходимо учитывать значительную усадку при пиролизе. [ нужна цитата ]
Трисилоксаны можно использовать в качестве жидкости для диффузионных насосов .
Циклометиконы представляют собой группу метилсилоксанов, класс жидких силиконов (циклические полидиметилсилоксановые полимеры), которые обладают характеристиками низкой вязкости и высокой летучести , а также являются смягчающими средствами для кожи и в определенных обстоятельствах полезными чистящими растворителями. [7] В отличие от диметиконов , которые представляют собой линейные силоксаны, которые не испаряются , циклометиконы являются циклическими : обе группы состоят из основной цепи [(CH 3 ) 2 SiO] n . Они используются во многих косметических продуктах, включая дезодоранты и антиперспиранты, которые должны покрывать кожу, но не оставаться впоследствии липкими. [8] Компания Dow является крупным производителем циклометиконов. [9]
Циклометиконы, как и все силоксаны, разлагаются путем гидролиза с образованием силанолов . [10] Эти силанолы производятся в таких низких количествах, что не мешают гидролитическим ферментам. [11] Хотя некоторые циклометиконы структурно напоминают краун-эфиры , они лишь слабо связывают ионы металлов. [12]
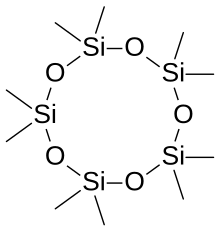
Слово силоксан происходит от слов кремний , кислород и алкан . В некоторых случаях силоксановые материалы состоят из нескольких различных типов силоксановых групп; они помечены в соответствии с количеством связей Si-O:
Поскольку силиконы широко используются в биомедицинских и косметических целях, их токсикология тщательно изучается. «Инертность силиконов по отношению к теплокровным животным была продемонстрирована в ряде испытаний». При LD 50 для крыс >50 г/кг они практически нетоксичны. [13] Однако остаются вопросы о хронической токсичности или последствиях биоаккумуляции, поскольку силоксаны могут быть долгоживущими.
Выводы о биоаккумуляции во многом основаны на лабораторных исследованиях. Полевые исследования биоаккумуляции не достигли консенсуса. «Даже если концентрации силоксанов, которые мы обнаружили в рыбе, высоки по сравнению с концентрациями классических загрязнителей, таких как ПХБ , несколько других исследований во фьорде Осло в Норвегии, озере Пепин в США и озере Эри в Канаде показали снижение концентрации силоксанов. на более высоком уровне в пищевой цепи. Это открытие поднимает вопрос о том, какие факторы влияют на потенциал биоаккумуляции силоксанов». [14]
Циклометиконы распространены повсеместно, поскольку они широко используются в биомедицинских и косметических целях. Их можно найти на высоких уровнях в американских городах. Они могут быть токсичными для водных животных в концентрациях, часто встречающихся в окружающей среде. [15] [16] Согласно одному сообщению, циклометиконы D 4 и D 5 обладают способностью к биоаккумуляции в некоторых водных организмах. [17]
В Европейском Союзе D 4 , D 5 и D 6 считаются опасными согласно регламенту REACH . Они были охарактеризованы как вещества, вызывающие очень большую озабоченность (SVHC) из-за их свойств PBT и vPvB. [18] Канада регулирует D 4 в соответствии с планом предотвращения загрязнения. [15] Научный обзор, проведенный в Канаде в 2011 году, пришел к выводу, что «силоксан D5 не представляет опасности для окружающей среды». [19]