
Сканирующая микроскопия ионной проводимости ( SICM ) — это метод сканирующей зондовой микроскопии , в котором в качестве кончика зонда используется электрод . [1] SICM позволяет определять топографию поверхности структур микрометрового и даже нанометрового диапазона [2] в водных средах проводящих электролитов. Образцы могут быть твердыми или мягкими, как правило, непроводящими, а неразрушающий характер измерений позволяет наблюдать живые ткани и клетки, а также биологические образцы в целом.
Он способен обнаруживать резкие изменения профиля в образцах [3] и может использоваться для картирования жесткости живой клетки [4] в тандеме с ее подробной топографией или для определения подвижности клеток во время их миграции. [5]
Сканирующая ионно-проводниковая микроскопия — метод, использующий повышение сопротивления доступа микропипетки в водную среду, содержащую электролит, при ее приближении к плохо проводящей поверхности. Он контролирует ионный ток, входящий и выходящий из микро/нанопипетки, что затруднено, если наконечник находится очень близко к поверхности образца, поскольку зазор, через который могут течь ионы, уменьшается в размере.
Установка SICM обычно выглядит следующим образом: напряжение подается между двумя электродами Ag/AgCl, один из которых находится в стеклянной микропипетке, а другой - в объемном растворе. Напряжение будет генерировать ионный ток между двумя электродами, текущий в микропипетку и из нее. Измеряется проводимость между двумя электродами, которая зависит от потока ионов.
Движения пипетки регулируются пьезоэлектриками .
Микропипетку опускают все ближе и ближе к образцу, пока поток ионов не начнет ограничиваться. При этом проводимость системы уменьшится (а сопротивление увеличится). Когда это сопротивление достигает определенного порога, наконечник останавливают и записывают положение. Затем наконечник перемещается (по-разному в зависимости от используемого режима, см. ниже) и проводится еще одно измерение в другом месте и так далее. В конечном итоге сравнение положений всех измерений дает подробный профиль высоты образца.
Важно отметить, что наконечник останавливается перед контактом с образцом, поэтому он не изгибается и не повреждает наблюдаемую поверхность, что является одним из основных преимуществ SICM.

Общее сопротивление установки (Rtot) представляет собой сумму трех сопротивлений: Rb, Rm и Rt. Rb сопротивление раствора электролита между кончиком микропипетки и электродом в объеме раствора. Rm — сопротивление раствора электролита между электродом микропипетки и наконечником. Rt — сопротивление тока, протекающего через наконечник.
Rb и Rm зависят от проводимости электролита, положения и формы Ag/AgCl-электродов. Rt зависит от размера и формы отверстия, а также от расстояния между иглой и образцом.
Все параметры, за исключением расстояния между зондом и образцом, постоянны в пределах данной установки SICM, поэтому именно изменение Rt в зависимости от расстояния до образца будет использоваться для определения топографии образца.
Обычными приближениями являются: 1) падением напряжения на поверхности электродов Ag/AgCl пренебрегают, предполагается, что оно пренебрежимо мало по сравнению с падением напряжения на острие и постоянно, 2) тот факт, что объемное сопротивление представляет собой Функцией d пренебрегаем, так как она зависит от расстояния между иглой и электродом в объеме.
SICM имеет худшее разрешение, чем AFM или STM , которые обычно могут достигать разрешения около 0,1 нм. Разрешение измерения SICM теоретически ограничено 1,5-кратным диаметром отверстия иглы [7] , но измерения, проведенные с диаметром отверстия 13 нм, позволили получить разрешение около 3–6 нм. [2]
SICM можно использовать для изображения плохо проводящих или непроводящих поверхностей, [6] что невозможно с помощью СТМ.
При измерениях SICM кончик микропипетки не касается поверхности образца; что позволяет визуализировать мягкие образцы (клетки, биологические образцы, клеточные ворсинки) [8] [9] [10] без деформации.
SICM используется в растворе, содержащем электролит, поэтому его можно использовать в физиологических средах для визуализации живых клеток и тканей, а также для мониторинга биологических процессов во время их протекания. [10]
В прыжковом режиме он способен правильно определять профили с крутыми уклонами и канавками.
В SICM существует четыре основных режима визуализации: режим постоянного z, режим постоянного тока (постоянное расстояние), режим переменного тока и режим подхода прыжком/назад/стоя.
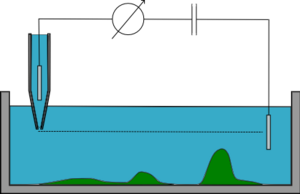
В режиме постоянного z микропипетка поддерживается на постоянной высоте z (высота), пока ее перемещают вбок, и отслеживают сопротивление, его изменения позволяют восстановить топографию образца. Этот режим быстрый, но почти не используется, поскольку работает только с очень плоскими сэмплами. Если образец имеет неровную поверхность, пипетка либо врежется в него, либо окажется слишком далеко для визуализации большей части образца.
В режиме постоянного тока (DC) (режим постоянного расстояния) микропипетка опускается по направлению к образцу до тех пор, пока не будет достигнуто заданное сопротивление. Затем пипетку перемещают вбок, и петля обратной связи поддерживает расстояние до образца (по значению сопротивления). Положение пипетки по оси Z определяет топографию образца. Этот режим не обнаруживает крутых наклонов образца, в таких случаях может контактировать с образцом и склонен к дрейфу электрода.

В режиме переменного тока (AC) микропипетка совершает вертикальные колебания в дополнение к своему обычному движению. Пока пипетка еще находится далеко от поверхности, ионный ток и сопротивление постоянны, поэтому пипетку опускают. Как только сопротивление начинает колебаться, амплитуда служит обратной связью для модуляции положения до тех пор, пока не будет достигнута заранее заданная амплитуда. [8] [9]
Отклик компонента переменного тока увеличивается намного круче, чем компонента постоянного тока, и позволяет записывать более сложные сэмплы.

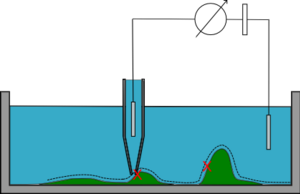
В режиме прыжка (шаг назад/стоя) микропипетка опускается к образцу до тех пор, пока не будет достигнуто заданное сопротивление, и высота фиксируется. Затем пипетку оттаскивают назад, перемещают вбок и производят еще одно измерение, и процесс повторяется. Затем можно восстановить топографию образца.
Прыжковый режим работает медленнее остальных, но способен отображать сложную топографию и даже целые клетки, не искажая поверхность образца. [11] · . [12]
SICM использовали для изображения живой нервной клетки мозга крысы, [5] определения жизненного цикла микроворсинок, [8] наблюдения за движением белковых комплексов в сперматозоидах. [2]
SICM сочетается с флуоресцентной микроскопией [2] и резонансным переносом энергии Фёрстера. [13]
SICM использовался по методу «умного патч-зажима», при котором пипетка присасывалась к поверхности клетки путем присасывания и затем контролировалась активность натриевых каналов в клеточной мембране. [14]
Сочетание АСМ и SICM позволило получить изображения синтетических мембран в ионных растворах с высоким разрешением. [15]
С SICM использовалась сканирующая оптическая микроскопия ближнего поля ; Измерение SICM позволило разместить кончик пипетки очень близко к поверхности образца. Флуоресцентные частицы, поступающие изнутри микропипетки, служат источником света для постоянно обновляющегося СБОМ и предотвращают фотообесцвечивание. [16] [17]
Недавно был разработан FSICM [18] (Fast SICM), значительно улучшающий скорость режима скачкообразной перестройки.