
В координационной химии первая координационная сфера относится к массиву молекул и ионов ( лигандов ), непосредственно присоединенных к центральному атому металла . Вторая координационная сфера состоит из молекул и ионов, которые присоединены различными способами к первой координационной сфере.
Первая координационная сфера относится к молекулам, которые присоединены непосредственно к металлу. Взаимодействия между первой и второй координационными сферами обычно включают водородные связи. Для заряженных комплексов важно ионное спаривание .
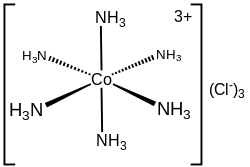
В хлориде гексамминкобальта(III) ([Co(NH 3 ) 6 ]Cl 3 ) катион кобальта плюс 6 аммиачных лигандов составляют первую координационную сферу. Координационная сфера этого иона, таким образом, состоит из центрального ядра MN 6 , «украшенного» 18 связями N−H, которые расходятся наружу.

Ионы металлов можно описать как состоящие из серии двух концентрических координационных сфер, первой и второй. Более удаленные от второй координационной сферы молекулы растворителя ведут себя скорее как « объемный растворитель ». Моделирование второй координационной сферы представляет интерес для вычислительной химии . Вторая координационная сфера может состоять из ионов (особенно в заряженных комплексах), молекул (особенно тех, которые связываются водородом с лигандами в первой координационной сфере) и частей основной цепи лиганда. По сравнению с первой координационной сферой, вторая координационная сфера имеет менее прямое влияние на реакционную способность и химические свойства металлокомплекса. Тем не менее, вторая координационная сфера имеет отношение к пониманию реакций металлокомплекса, включая механизмы обмена лигандами и катализа.
Механизмы металлопротеинов часто вызывают модуляцию второй координационной сферы белком. [1]

Скорости, с которыми лиганды обмениваются между первой и второй координационной сферой, являются первым шагом в реакциях замещения лигандов. При ассоциативном замещении лигандов входящий нуклеофил находится во второй координационной сфере. Эти эффекты имеют отношение к практическим применениям, таким как контрастные вещества, используемые в МРТ . [4]
Энергетика внутрисферных реакций переноса электронов обсуждается в терминах второй координационной сферы. Некоторые реакции переноса электронов с участием протонов включают перенос атомов между вторыми координационными сферами реагентов:
Влияние растворителя на цвета и стабильность часто объясняется изменениями во второй координационной сфере. Такие эффекты могут быть выражены в комплексах, где лиганды в первой координационной сфере являются сильными донорами и акцепторами водородных связей, например, соответственно [Co(NH 3 ) 6 ] 3+ и [Fe(CN) 6 ] 3− . Краун-эфиры связываются с полиаминовыми комплексами через свою вторую координационную сферу. Полиаммониевые катионы связываются с азотными центрами цианометаллатов. [5]
Макроциклические молекулы, такие как циклодекстрины, часто действуют как вторая координационная сфера для комплексов металлов. [6] [7]