ДНК-топоизомеразы (или топоизомеразы ) — это ферменты, которые катализируют изменения в топологическом состоянии ДНК , взаимопревращая расслабленные и сверхспиральные формы, связанные (сцепленные) и несвязанные виды, а также завязанную и не завязанную ДНК. [1] [2] Топологические проблемы в ДНК возникают из-за переплетенной природы ее двойной спиральной структуры, которая, например, может привести к перекручиванию дуплекса ДНК во время репликации и транскрипции ДНК . Если оставить это скручивание неизменным, это в конечном итоге остановит ДНК- или РНК-полимеразы, участвующие в этих процессах, от продолжения движения по спирали ДНК. Вторая топологическая проблема возникает из-за связывания или запутывания ДНК во время репликации. Оставшиеся нерешенными связи между реплицированной ДНК будут препятствовать делению клеток. ДНК-топоизомеразы предотвращают и исправляют эти типы топологических проблем. Они делают это, связываясь с ДНК и разрезая сахарофосфатный остов либо одной (топоизомеразы типа I), либо обеих (топоизомеразы типа II) цепей ДНК. Этот временный разрыв позволяет распутать или размотать ДНК, и в конце этих процессов остов ДНК снова запечатывается. Поскольку общий химический состав и связность ДНК не изменяются, субстрат и продукт ДНК являются химическими изомерами, отличающимися только своей топологией.
Первая ДНК-топоизомераза была обнаружена в бактериях Джеймсом С. Ваном в 1971 году и изначально была названа ω (омега)-белком; [3] теперь она называется топоизомеразой I Escherichia coli ( E. coli ) (topo I) и является представителем семейства ферментов типа IA. Впоследствии похожая активность была обнаружена в эукариотических клетках (печень крысы) Джеймсом Шампу и Ренато Дульбекко; [4] ответственный фермент, эукариотический topo I, имеет особый механизм и является представителем семейства типа IB. Первой топоизомеразой типа II, которая была обнаружена, была ДНК-гираза из бактерий, Мартином Геллертом и его коллегами в 1976 году, [5] а также охарактеризованная Николасом Коццарелли и его коллегами. [6] ДНК-гираза катализирует введение отрицательных супервитков в ДНК и является единственным ферментом типа II, который делает это, все остальные катализируют релаксацию ДНК. Ферменты типа II механически отличаются от типа I тем, что зависят от АТФ и временно расщепляют обе цепи ДНК, а не только одну. Топоизомеразы типа II впоследствии были идентифицированы из бактериальных вирусов и эукариот. [7] [8] [9] Топо EC-коды следующие: АТФ-независимый (тип I), EC 5.6.2.1; АТФ-зависимый (тип II): EC 5.6.2.2. Исключением среди топоизомераз типа I является обратная гираза, которая содержит домен геликазы (EC 3.6.4.12) и вводит положительную суперспирализацию АТФ-зависимым образом. Поэтому это единственная топоизомераза типа I, классифицированная как EC 5.6.2.2 (таблица 1).
Двойная спиральная структура ДНК подразумевает переплетение двух полинуклеотидных цепей друг вокруг друга, что потенциально приводит к топологическим проблемам. Топология ДНК относится к пересечению двух цепей ДНК, которое изменяет скручивание двойной спирали и приводит к третичным конформациям ДНК, таким как суперспирали, узлы и катенаны. [10] Потенциальные топологические проблемы, связанные с двойной спиральной структурой ДНК, были обнаружены вскоре после того, как ее структура была впервые объяснена в 1953 году Джеймсом Уотсоном, Фрэнсисом Криком и Розалинд Франклин [11] [12] [13] и получили дальнейшее развитие в работах Макса Дельбрюка и Джона Кэрнса. [14] [15] Замкнутую кольцевую двухцепочечную ДНК можно описать тремя параметрами: числом зацеплений (Lk), скручиванием (Tw) и скручиванием (Wr) (рис. 1). Где Lk относится к числу раз, когда две нити связаны, Tw относится к числу витков спирали ДНК, измеренному относительно оси спирали, а Wr количественно характеризует скручивание пути спирали ДНК в пространстве и часто приравнивается к «суперспирализации».

Три параметра связаны следующим образом: Lk = Tw +Wr. Это математическое тождество первоначально получено Кэлугэряну в 1959 году [16] и называется теоремой Кэлугэряну или Кэлугэряну–Уайта–Фуллера. [17] [18] Lk нельзя изменить, не разорвав одну или обе нити спирали; Tw и Wr взаимопревращаемы и зависят от условий раствора. Суперспирализация — это разговорный термин для ДНК с ненулевой разницей в связывании, более правильно называемый специфической разницей в связывании (σ = ΔLk/Lk 0 , где Lk 0 — среднее число зацеплений расслабленного кольца ДНК). Говорят, что ДНК положительно суперспирализована, если ее Lk выше, чем Lk 0 для расслабленного состояния (Lk-Lk o = ΔLk, ΔLk>0); это означает, что Tw и/или Wr увеличиваются относительно расслабленной молекулы. Наоборот, ДНК отрицательно суперспирализована, если Lk молекулы ниже Lk 0 (ΔLk<0).
Последствия топологических возмущений в ДНК иллюстрируются репликацией ДНК, во время которой нити дуплекса разделяются; это разделение приводит к образованию положительных суперспиралей (перекручивание или перекручивание ДНК) перед репликационной вилкой и переплетению дочерних нитей (прекатенанов) позади [10] [19] (рис. 2). Если положительные суперспирали не расслаблены, прогрессирование репликационной вилки затруднено, тогда как неспособность расцепить дочерние нити предотвращает сегрегацию генома, которая необходима для деления клетки. [20] Транскрипция РНК-полимеразой также генерирует положительную суперспирализацию впереди и отрицательную суперспирализацию позади транскрипционного комплекса (рис. 2). Этот эффект известен как модель домена с двойной суперспиралью, описанная Лероем Лю и Джеймсом Ваном в 1987 году. [21] Эти топологические возмущения должны быть разрешены для продолжения метаболизма ДНК, что позволяет клетке эффективно реплицировать, транскрибировать и разделять геном, обеспечивая клеточное деление и жизнеспособность. Узлы в ДНК можно обнаружить в бактериофагах и в качестве продуктов реакций рекомбинации. [10] В целом, узлы в ДНК вредны и должны быть удалены (топоизомеразами). Катенаны ДНК образуются при репликации кольцевых молекул и должны быть разрешены топоизомеразами или рекомбиназами, чтобы обеспечить надлежащее разделение дочерних молекул во время деления клетки. В дополнение к вредным аспектам топологии ДНК, которые требуют разрешения, существуют и полезные аспекты. Например, репликация плазмиды требует отрицательной суперспирализации начала, что облегчает локальное плавление и обнажает одноцепочечную ДНК, необходимую для инициации репликации. Аналогично, инициация репликации из основного бактериального источника oriC также требует отрицательной суперспирализации. [22] [23] Более того, уплотнение генома E. coli достигается частично за счет отрицательной суперспирализации.

ДНК-топоизомеразы — это ферменты, которые эволюционировали для решения топологических проблем в ДНК (таблица 2). [10] Они делают это посредством временного разрыва одной или обеих цепей ДНК. Это привело к классификации топосов на два типа: тип I, которые катализируют реакции, включающие временные одноцепочечные разрывы, и тип II, которые катализируют реакции, включающие временные двухцепочечные разрывы (рис. 3; таблица 2). В рамках этих классификаций существуют подтипы.
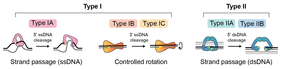
Эти ферменты катализируют изменения в топологии ДНК посредством временных одноцепочечных разрывов в ДНК. Реакции могут происходить как на одно-, так и на двухцепочечных субстратах ДНК и могут протекать по механизму «поворота» или «прохода нити» (рис. 3). Диапазон реакций включает: релаксацию суперспирали ДНК, распутывание одноцепочечных колец и декатенацию, при условии, что хотя бы один партнер имеет одноцепочечный участок. В случае архейного фермента, обратной гиразы, возможна положительная суперспирализация ДНК. [24]
Тип IA является мономерным и связывается с одноцепочечными сегментами ДНК. Они вносят временный одноцепочечный разрыв посредством образования тирозилфосфатной связи между тирозином в ферменте и 5′-фосфатом в ДНК. Сегмент ДНК, в котором происходит разрыв, называется «воротами» или G-сегментом, и его расщепление позволяет пройти другому сегменту ДНК, «транспортному» или T-сегменту, в процессе «прохода цепи». [25] За этим следует лигирование G-сегмента. Для того чтобы произошел проход цепи, топо IA должен претерпеть конформационное изменение, чтобы открыть ворота ДНК и обеспечить перенос T-сегмента. Во время реакции релаксации ДНК этот процесс изменяет число связей ДНК на +/-1 (рис. 4). Примерами топоизомераз типа IA являются прокариотические topo I и III, эукариотические topo IIIα и IIIβ и архейный фермент обратная гираза. Обратная гираза, которая встречается в термофильных археях, включает topo типа IA, соединенный с геликазой, и является единственным известным ферментом, который может вводить положительные супервитки в ДНК. [24] Ген, кодирующий обратную гиразу, также обнаружен в некоторых группах термофильных бактерий, куда он, вероятно, был перенесен путем горизонтального переноса генов из архей. [26]

Топоизомеразы типа IB катализируют реакции, включающие временные одноцепочечные разрывы в ДНК посредством образования тирозилфосфатной связи между тирозином в ферменте и 3′-фосфатом в ДНК. Вместо того, чтобы использовать механизм прохождения цепи, эти ферменты работают посредством «поворота» или «контролируемого вращения» расщепленной цепи вокруг неповрежденной цепи. [27] Этот механизм контролируемого вращения был впервые описан для Vaccinia topo I [27] [28] и допускает вращение свободного конца ДНК вокруг неповрежденной цепи, скорость которого контролируется «трением» внутри полости фермента, до того, как надрез будет повторно лигирован (рис. 3). Это приводит к переменному изменению числа связей на событие расщепления и повторного лигирования. Этот механизм отличается от механизма ферментов типа IA, и эти две группы ферментов структурно и эволюционно не связаны. Примерами топоизомераз типа IB являются эукариотическая ядерная и митохондриальная топо I, а также вирусная топо I , хотя они были обнаружены во всех трех доменах жизни.
Топоизомеразы типа IC имеют схожий механизм с ферментами типа IB, но структурно отличаются. Единственным представителем является топо V, обнаруженный в гипертермофиле Methanopyrus kandleri . [29]
Топоизомеразы типа II катализируют изменения в топологии ДНК посредством временных двухцепочечных разрывов в ДНК. Реакции происходят на двухцепочечных субстратах ДНК и протекают через механизм прохождения цепи (рис. 5). Диапазон реакций включает релаксацию ДНК, суперспирализацию ДНК, распутывание и декатенацию. В то время как все топоизомеразы типа II могут катализировать релаксацию ДНК, гираза, архетипическая бактериальная топоизомераза, может также вводить отрицательные супервитки. В отличие от топоизомераз типа I, которые, как правило, являются мономерными, топоизомеразы типа II являются гомодимерами или гетеротетрамерами. Они классифицируются на два подтипа на основе эволюционных, структурных и механистических соображений. Общий механизм прохождения цепи для топоса типа II начинается со связывания одного дуплекса ДНК, называемого сегментом ворот (G-сегментом), в воротах ДНК. Другой дуплекс, называемый транспортным сегментом (T-сегментом), захватывается зажимом, управляемым АТФ, и проходит через временный разрыв в G-сегменте, включающий 5'-фосфотирозиновые связи в обеих цепях, прежде чем он высвобождается через C-ворота, а G-сегмент повторно лигируется (рис. 5). Оборот фермента требует связывания и гидролиза АТФ.

Топоизомеразы типа IIA катализируют временные двухцепочечные разрывы в ДНК посредством образования тирозилфосфатных связей между тирозинами в ферменте (по одному на каждой субъединице) и 5'-фосфатами, смещенными на 4 основания в противоположных цепях ДНК. Реакция прохождения цепи может быть внутри- или межмолекулярной (рис. 5), что позволяет изменять суперспирализацию и завязывание узлов или разрыв связей соответственно. Этот процесс изменяет число связей ДНК на +/-2. Примерами топоизомераз типа IIA являются эукариотические topo IIα и topo IIβ , а также бактериальная гираза и topo IV. ДНК-гираза соответствует тому же механизму двухцепочечного перехода, что и другие ферменты типа II, но имеет уникальные особенности, связанные с ее способностью вводить отрицательные суперспирали в ДНК. Сегмент G является частью гораздо более длинного куска ДНК (>100 п.н.), который обернут вокруг фермента, одно плечо которого образует T-сегмент, проходящий через двухцепочечный разрыв (рис. 5). В случае гиразы значительное количество свободной энергии от гидролиза АТФ преобразуется в крутильное напряжение в ДНК, т.е. суперспирализация является процессом, требующим энергии. [30] Кроме того, в отсутствие АТФ гираза способна удалять отрицательные суперспирали в более медленной реакции релаксации ДНК.
Тип IIB также катализирует временные двухцепочечные разрывы посредством образования тирозилфосфатных связей между тирозинами в ферменте и 5′-фосфатами в противоположных цепях ДНК, но в случае ферментов IIB двухцепочечные разрывы имеют 2-основной сдвиг. Ферменты типа IIB демонстрируют важные структурные различия, но эволюционно связаны с ферментами типа IIA. Эти различия включают отсутствие одного из белковых «ворот» (ворота C) (рис. 5). Первоначально обнаруженные у архей, они также были обнаружены у эукариот и, в частности, у растений; примеры включают topo VI и topo VIII. Topo VI является наиболее изученным ферментом этого подтипа и считается предпочтительной декатеназой. [31]
Для неспециалиста, возможно, наиболее важным аспектом топоизомераз является их роль в качестве лекарственных мишеней как для антибактериальной, так и для противораковой химиотерапии; несколько антибактериальных и противораковых препаратов, нацеленных на топоизомеразу, включены в Модельный список основных лекарственных средств Всемирной организации здравоохранения 2019 года. Причина этой известности заключается в том, что их реакции протекают через временные разрывы в ДНК, которые, если стабилизируются связыванием с лекарством, могут привести к гибели клетки из-за образования токсичных одно- или двухцепочечных разрывов в геномной ДНК. Большинство препаратов, нацеленных на топоизомеразу, действуют таким образом, то есть они стабилизируют промежуточное ковалентное расщепление фермента и ДНК. [32] [33] [34]
Хотя топо I типа, такие как бактериальный топо I, являются жизнеспособными мишенями для антибиотиков, [35] в настоящее время нет соединений в клиническом использовании, которые нацелены на эти ферменты. Однако ферменты типа II, ДНК-гираза и ДНК-топоизомераза IV, пользовались огромным успехом в качестве мишеней для широко используемых фторхинолоновых антибиотиков (рис. 6).
Хинолоновые антибактериальные соединения были впервые разработаны в 1960-х годах и используются в клинической практике с 1980-х годов. [36] Производные FQ, такие как ципрофлоксацин, левофлоксацин и моксифлоксацин (рис. 6), оказались весьма успешными. Эти соединения работают, взаимодействуя со своей целью (гиразой или топо IV) и ДНК в месте расщепления, чтобы стабилизировать промежуточное ковалентное расщепление ДНК-белок. В частности, они интеркалируют в ДНК и предотвращают стадию повторного лигирования ДНК в реакции топоизомеразы (рис. 5). Это высокоэффективный механизм ингибирования, который также используется несколькими противораковыми препаратами, нацеленными на топоизомеразу. Несмотря на их впечатляющий успех, устойчивость к FQ является серьезной проблемой. [36] Ряд других соединений, таких как хиназолиндионы и имидазолпиразиноны, [37] действуют аналогичным образом, и есть надежда, что некоторые из них заменят фторхинолоны в будущем.
Аминокумарины (рис. 6), такие как новобиоцин, хлоробиоцин и кумермицин А 1 , являются натуральными продуктами Streptomyces, которые ингибируют реакцию АТФазы гиразы и топо IV. [37] Хотя они могут быть очень эффективными против своей цели, они страдают от проблем с проницаемостью и токсичностью и, таким образом, не достигли такого уровня клинического успеха, как фторхинолоны.
Существует ряд белковых ингибиторов гиразы, включая бактериальные токсины CcdB, MccB17 и ParE, [38] [39] [40] , которые стабилизируют комплекс расщепления, подобно FQ. Хотя эти белки не являются жизнеспособными в качестве антибактериальных средств, их способ действия может вдохновить на разработку новых антибактериальных соединений. Другие белковые ингибиторы гиразы предотвращают связывание ДНК топоизомеразой, а не стабилизируют комплексы расщепления. К ним относятся YacG [41] и белки пентапептидного повтора, такие как QnrB1 и MfpA; [42] [43] эти белковые ингибиторы также придают устойчивость к фторхинолонам.

Как человеческие топо I, так и топо II (как α-, так и β-изоформы) могут быть мишенью противораковой химиотерапии (рис. 7). [32] [33] [44] [45] [46] [47] Большинство этих соединений действуют аналогично фторхинолонам, то есть стабилизируют комплекс ковалентного расщепления ДНК-белок; за это их стали называть ядами топоизомеразы, в отличие от каталитических ингибиторов. [33] [34] [48] Несколько ингибиторов человеческой топоизомеразы включены в Список основных лекарственных средств Всемирной организации здравоохранения .
Камптотецин (рис. 7), первоначально полученный из дерева Camptotheca acuminata , нацелен на человеческий topo I, а производные, такие как топотекан и иринотекан, широко используются в химиотерапии рака. [33] Камптотецин и его производные действуют, стабилизируя комплекс расщепления topo I, предотвращая повторное лигирование опосредованного белком разрыва в ДНК. Эти интерфейсные ингибиторы стабилизируются за счет взаимодействия стекирования с разорванной ДНК и водородной связи с ферментом. Хотя производные CPT стабилизируют комплекс расщепления одноцепочечной ДНК, последующие столкновения с репликационным или транскрипционным аппаратом, как полагают, приводят к токсичным разрывам двухцепочечной ДНК. Эти соединения используются в качестве терапии первой или второй линии для лечения рака, включая колоректальный, яичниковый, легких, молочной железы и шейки матки. Однако производные CPT страдают от ограничений, связанных с токсичностью и ограниченными терапевтическими периодами полураспада из-за химической нестабильности. Новые ингибиторы топо I, инденоизохинолины и фторинденоизохинолины, преодолевают ограничения производных CPT и в настоящее время проходят клинические испытания. [49]
Этопозид (рис. 7) и его близкий родственник тенипозид (VM-26) являются производными эпиподофиллотоксина, полученными из корневища дикой мандрагоры, которые нацелены на топо II, стабилизируя комплекс ковалентного расщепления и предотвращая повторное лигирование расщепленной ДНК. [46] Они обычно используются в сочетании с другими химиотерапевтическими препаратами для лечения рака, включая опухоли яичек, мелкоклеточный рак легких и лейкемию. Лечение этопозидом может привести к вторичным лейкозам, возникающим из-за определенных геномных транслокаций, в основном с участием топо IIβ. [46]

Доксорубицин (рис. 7) и родственные производные даунорубицин, эпирубицин и идарубицин являются антрациклинами, полученными из бактерии Streptomyces [48] , которые нацелены на человеческий topo II, стабилизируя комплекс расщепления аналогично другим ядам топоизомеразы. Митоксантрон является синтетическим антрацендионом, который химически и функционально похож на антрациклины. [47] Антрациклины были первыми ингибиторами топоизомеразы, используемыми для лечения рака, и остаются одними из наиболее широко используемых и эффективных методов лечения широкого спектра видов рака, включая рак молочной железы, лимфому, лейкемию, карциному, саркому и другие опухоли. [47] Эти соединения являются агентами, интеркалирующими ДНК, и как таковые могут влиять на широкий спектр клеточных процессов ДНК в дополнение к специфическому отравлению topo II. [33] Дополнительная цитотоксичность возникает из окислительно-восстановительных реакций с участием антрациклинов, которые генерируют активные формы кислорода. Генерация активного кислорода, наряду с отравлением топо IIβ, приводит к ограничивающей дозу кардиотоксичности антрациклинов. [33]
Мербарон является производным тиобарбитуровой кислоты, а дексразоксан (ICRF-187), одно из нескольких родственных производных бисдиоксопиперазина (рис. 7), являются примерами каталитических ингибиторов топо II, т. е. они предотвращают завершение каталитического цикла топо II, но не стабилизируют комплекс расщепления ДНК. Хотя эти каталитические ингибиторы проявляют цитотоксичность и были протестированы в клинических испытаниях, в настоящее время они не используются в клинической практике для лечения рака. [47] Однако дексразоксан, который блокирует гидролиз АТФ топо II, используется для предотвращения кардиотоксичности, связанной с антрациклинами. [50] [51]
По крайней мере одна топоизомераза, ДНК-топоизомераза II бета (topo IIβ), играет регуляторную роль в транскрипции генов. Зависимые от Topo IIβ двухцепочечные разрывы ДНК и компоненты механизма восстановления повреждений ДНК важны для быстрой экспрессии немедленных ранних генов , а также для регуляции генов, реагирующей на сигнал. [52] [53] [54] [55] Topo IIβ, вместе с другими связанными ферментами, [54] по-видимому, важен для высвобождения приостановленной РНК-полимеразы в высокотранскрибируемых или длинных генах. [56] [57] [58]
Стимул-индуцированные двухцепочечные разрывы ДНК (DSB), которые ограничены краткосрочным периодом (от 10 минут до 2 часов), индуцируются topo IIβ в промоторных областях генов, регулируемых сигналом. Эти DSB позволяют быстро повышать экспрессию таких генов, чувствительных к сигналу, в ряде систем (см. таблицу ниже). Эти гены, регулируемые сигналом, включают гены, активируемые в ответ на стимуляцию эстрогеном , сывороткой , инсулином , глюкокортикоидами (такими как дексаметазон ) и активацию нейронов. Когда индуцированный двухцепочечный разрыв ДНК был восстановлен, транскрипция гена, чувствительного к сигналу, возвращается к низкому базальному уровню. [52]

Было обнаружено, что Topo IIβ и PARP-1 постоянно присутствуют на умеренном уровне вблизи места начала транскрипции промотора гена, реагирующего на сигнал. После того, как произошел сигнал, topo IIβ вызвал двухцепочечный разрыв, и PARP-1 был вовлечен в замену гистона H1 на HMGB1 / HMGA2 , что может способствовать транскрипции. [55] Topo IIβ и PARP-1 увеличились в месте двухцепочечного разрыва и компонентов негомологичного пути репарации ДНК, соединяющего концы, включая DNA-PKcs, Ku70/Ku80 и ДНК-лигазу IV, собранную с topo IIβ и PARP-1. Вся эта сборка присутствовала в линкерной ДНК, смежной с одной нуклеосомой в промоторной области гена (см. рисунок). Нуклеосома была близка к месту начала транскрипции гена. [55] Компоненты пути репарации негомологичного соединения концов ДНК были необходимы для закрытия двухцепочечного разрыва ДНК. [52]
РНК-полимераза II часто имеет сайт паузы, который находится примерно в 30–60 нуклеотидах ниже сайта начала транскрипции гена. [64] [65] Считается, что пауза РНК-полимеразы II в этих сайтах и контролируемое высвобождение паузы играют регуляторную роль в транскрипции генов. Как указали Сингх и др., [58] «около 80% высокоэкспрессируемых генов в клетках HeLa приостановлены». Очень кратковременные, но не немедленно запечатываемые двухцепочечные разрывы ДНК, вызванные topo IIβ, происходят в сайтах паузы РНК-полимеразы II и, по-видимому, необходимы для эффективного высвобождения состояния паузы и перехода к транскрипции гена. [56] [57] [58] Для генов, в которых это происходит, двухцепочечный разрыв ДНК, вызванный TOP2B, считается частью процесса регуляции экспрессии генов.