Рецепторы клеточной поверхности ( мембранные рецепторы , трансмембранные рецепторы ) — это рецепторы , встроенные в плазматическую мембрану клеток . [1] Они участвуют в передаче сигналов клетками, получая (связываясь) внеклеточные молекулы . Это специализированные интегральные мембранные белки, которые обеспечивают связь между клеткой и внеклеточным пространством . Внеклеточные молекулы могут быть гормонами , нейротрансмиттерами , цитокинами , факторами роста , молекулами клеточной адгезии или питательными веществами ; они реагируют с рецептором, вызывая изменения в метаболизме и активности клетки. В процессе передачи сигнала связывание лиганда влияет на каскадное химическое изменение через клеточную мембрану.
Многие мембранные рецепторы являются трансмембранными белками . Существуют различные виды, включая гликопротеины и липопротеины . [2] Известны сотни различных рецепторов, и еще многие из них еще предстоит изучить. [3] [4] Трансмембранные рецепторы обычно классифицируются на основе их третичной (трехмерной) структуры. Если трехмерная структура неизвестна, их можно классифицировать на основе топологии мембраны . В простейших рецепторах полипептидные цепи пересекают липидный бислой один раз, в то время как другие, такие как рецепторы, сопряженные с G-белком , пересекают до семи раз. Каждая клеточная мембрана может иметь несколько видов мембранных рецепторов с различным распределением поверхности. Один рецептор также может быть по-разному распределен в разных положениях мембраны в зависимости от вида мембраны и клеточной функции. Рецепторы часто сгруппированы на поверхности мембраны, а не распределены равномерно. [5] [6]
Для объяснения механизма действия трансмембранных рецепторов были предложены две модели.

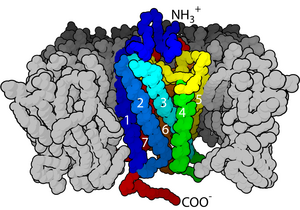
Трансмембранные рецепторы в плазматической мембране обычно можно разделить на три части.
Внеклеточный домен находится снаружи клетки или органеллы . Если полипептидная цепь пересекает бислой несколько раз, внешний домен содержит петли, переплетенные через мембрану. По определению, основная функция рецептора — распознавать и реагировать на тип лиганда. Например, нейромедиатор , гормон или атомные ионы могут связываться с внеклеточным доменом как лиганд, связанный с рецептором. Klotho — это фермент, который заставляет рецептор распознавать лиганд ( FGF23 ).
Два наиболее распространенных класса трансмембранных рецепторов — это GPCR и однопроходные трансмембранные белки . [8] [9] В некоторых рецепторах, таких как никотиновый ацетилхолиновый рецептор , трансмембранный домен образует белковую пору через мембрану или вокруг ионного канала . При активации внеклеточного домена путем связывания соответствующего лиганда пора становится доступной для ионов, которые затем диффундируют. В других рецепторах трансмембранные домены претерпевают конформационные изменения при связывании, что влияет на внутриклеточные условия. В некоторых рецепторах, таких как члены суперсемейства 7TM , трансмембранный домен включает карман для связывания лиганда.
Внутриклеточный (или цитоплазматический ) домен рецептора взаимодействует с внутренней частью клетки или органеллы, передавая сигнал. Существует два основных пути этого взаимодействия:

Процессы передачи сигнала через мембранные рецепторы включают внешние реакции, в которых лиганд связывается с мембранным рецептором, и внутренние реакции, в которых запускается внутриклеточный ответ. [10] [11]
Передача сигнала через мембранные рецепторы состоит из четырех частей:

Мембранные рецепторы в основном делятся по структуре и функциям на 3 класса: рецепторы, связанные с ионными каналами ; рецепторы, связанные с ферментами ; и рецепторы, связанные с G-белком .
Во время события передачи сигнала в нейроне нейротрансмиттер связывается с рецептором и изменяет конформацию белка. Это открывает ионный канал, позволяя внеклеточным ионам проникать в клетку. Ионная проницаемость плазматической мембраны изменяется, и это преобразует внеклеточный химический сигнал во внутриклеточный электрический сигнал, который изменяет возбудимость клетки . [12]
Рецептор ацетилхолина — это рецептор, связанный с катионным каналом. Белок состоит из четырех субъединиц: альфа (α), бета (β), гамма (γ) и дельта (δ). Существует две субъединицы α, каждая из которых имеет один сайт связывания ацетилхолина . Этот рецептор может существовать в трех конформациях. Закрытое и незанятое состояние является нативной конформацией белка. Поскольку две молекулы ацетилхолина связываются с сайтами связывания на субъединицах α, конформация рецептора изменяется, и ворота открываются, позволяя проникать множеству ионов и небольших молекул. Однако это открытое и занятое состояние длится лишь непродолжительное время, а затем ворота закрываются, становясь закрытым и занятым состоянием. Две молекулы ацетилхолина вскоре диссоциируют от рецептора, возвращая его в нативное закрытое и незанятое состояние. [13] [14]

По состоянию на 2009 год известно 6 типов рецепторов, связанных с ферментами : рецепторные тирозинкиназы ; рецепторы, ассоциированные с тирозинкиназой; рецептороподобные тирозинфосфатазы ; рецепторные сериновые / треониновые киназы ; рецепторные гуанилатциклазы и гистидинкиназные рецепторы. Рецепторные тирозинкиназы имеют самую большую популяцию и самое широкое применение. Большинство этих молекул являются рецепторами для факторов роста, таких как эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), фактор роста фибробластов (FGF), фактор роста гепатоцитов (HGF), фактор роста нервов (NGF) и гормонов, таких как инсулин . Большинство этих рецепторов будут димеризоваться после связывания со своими лигандами, чтобы активировать дальнейшую передачу сигнала. Например, после того, как рецептор эпидермального фактора роста (EGF) связывается со своим лигандом EGF, два рецептора димеризуются, а затем подвергаются фосфорилированию остатков тирозина в ферментной части каждой молекулы рецептора. Это активирует тирозинкиназу и катализирует дальнейшие внутриклеточные реакции.
Рецепторы, сопряженные с G-белком, представляют собой большое семейство трансмембранных рецепторов. Они встречаются только у эукариот . [15] Лиганды , которые связывают и активируют эти рецепторы, включают: светочувствительные соединения, запахи , феромоны , гормоны и нейротрансмиттеры . Они различаются по размеру от небольших молекул до пептидов и крупных белков . Рецепторы, сопряженные с G-белком, участвуют во многих заболеваниях и, таким образом, являются мишенями многих современных лекарственных препаратов. [16]
Существует два основных пути передачи сигнала, включающих рецепторы, сопряженные с G-белком: сигнальный путь цАМФ и сигнальный путь фосфатидилинозитола . [17] Оба опосредованы активацией G-белка . G-белок представляет собой тримерный белок с тремя субъединицами, обозначенными как α, β и γ. В ответ на активацию рецептора субъединица α высвобождает связанный гуанозиндифосфат (ГДФ), который замещается гуанозинтрифосфатом (ГТФ), тем самым активируя субъединицу α, которая затем диссоциирует от субъединиц β и γ. Активированная субъединица α может далее влиять на внутриклеточные сигнальные белки или целевые функциональные белки напрямую.
Если мембранные рецепторы денатурированы или дефицитны, передача сигнала может быть затруднена и вызвать заболевания. Некоторые заболевания вызваны нарушениями функции мембранных рецепторов. Это происходит из-за дефицита или деградации рецептора через изменения в генах, которые кодируют и регулируют рецепторный белок. Мембранный рецептор TM4SF5 влияет на миграцию гепатоцитов и гепатомы . [18] Кроме того, кортикальный рецептор NMDA влияет на текучесть мембраны и изменяется при болезни Альцгеймера. [19] Когда клетка инфицирована безоболочечным вирусом, вирус сначала связывается со специфическими мембранными рецепторами, а затем передает себя или субвирусный компонент на цитоплазматическую сторону клеточной мембраны. В случае полиовируса известно in vitro, что взаимодействие с рецепторами вызывает конформационные перестройки, которые высвобождают белок вириона, называемый VP4. N-конец VP4 миристилирован и, таким образом, гидрофобен【миристиновая кислота =CH 3 (CH 2 ) 12 COOH】. Предполагается, что конформационные изменения, вызванные связыванием с рецептором, приводят к присоединению миристиновой кислоты к VP4 и образованию канала для РНК.

Благодаря таким методам, как рентгеновская кристаллография и ЯМР-спектроскопия , информация о трехмерных структурах целевых молекул резко возросла, как и структурная информация о лигандах. Это стимулирует быстрое развитие структурно-ориентированного дизайна лекарств . Некоторые из этих новых лекарств нацелены на мембранные рецепторы. Современные подходы к структурно-ориентированному дизайну лекарств можно разделить на две категории. Первая категория касается определения лигандов для данного рецептора. Обычно это достигается с помощью запросов к базе данных, биофизического моделирования и построения химических библиотек. В каждом случае большое количество потенциальных молекул лигандов проверяются, чтобы найти те, которые соответствуют связывающему карману рецептора. Этот подход обычно называют лигандно-ориентированным дизайном лекарств. Ключевое преимущество поиска в базе данных заключается в том, что он экономит время и силы для получения новых эффективных соединений. Другой подход структурно-ориентированного дизайна лекарств заключается в комбинаторном картировании лигандов, что называется рецепторно-ориентированным дизайном лекарств. В этом случае молекулы лиганда конструируются в рамках ограничений связывающего кармана путем поэтапной сборки небольших фрагментов. Эти фрагменты могут быть как атомами, так и молекулами. Ключевым преимуществом такого метода является возможность обнаружения новых структур. [20] [21] [22]