В органической химии уравнение Гаммета описывает линейную зависимость свободной энергии , связывающую скорости реакций и константы равновесия для многих реакций с участием производных бензойной кислоты с мета- и пара- заместителями друг друга, всего с двумя параметрами: константой заместителя и константой реакции. [1] [2] Это уравнение было разработано и опубликовано Луи Плаком Хэмметом в 1937 году [3] как продолжение качественных наблюдений в его публикации 1935 года. [4]
Основная идея состоит в том, что для любых двух реакций с двумя ароматическими реагентами, отличающимися только типом заместителя, изменение свободной энергии активации пропорционально изменению свободной энергии Гиббса . [5] Это понятие не следует из элементной термохимии или химической кинетики и было введено Хэмметом интуитивно. [а]
Основное уравнение:
где
связывая константу равновесия , , для данной равновесной реакции с заместителем R и константу сравнения , когда R представляет собой атом водорода, с константой заместителя σ , которая зависит только от конкретного заместителя R, и константой скорости реакции ρ , которая зависит только от типа реакцию, но не на используемый заместитель. [4] [3]
Уравнение справедливо и для скоростей k ряда реакций с замещенными производными бензола:
В этом уравнении указана эталонная скорость реакции незамещенного реагента, а k - скорость замещенного реагента.
График зависимости данного равновесия от заданной скорости реакции со многими по-разному замещенными реагентами представляет собой прямую линию.
Отправной точкой для сбора констант заместителей является химическое равновесие , для которого константа заместителя произвольно устанавливается равной 0, а константа реакции устанавливается равной 1: депротонирование бензойной кислоты или бензолкарбоновой кислоты (R и R', оба H). в воде при температуре 25°С.

Получив значение K 0 , теперь определяют ряд констант равновесия (K) на основе того же процесса, но теперь с вариацией пара-заместителя - например, п-гидроксибензойной кислоты (R=OH, R'=H ) или п-аминобензойная кислота (R=NH 2 , R'=H) . Эти значения, объединенные в уравнение Гаммета с K 0 и с учетом того, что ρ = 1, дают константы пара-заместителей , приведенные в таблице 1 для аминных , метокси- , этокси- , диметиламино , метильных , фторсодержащих , бромных , хлорных , йодных , нитро- и цианозаместителей . . Повторение процесса с метазаместителями дает константы метазаместителей . Эта обработка не включает орто-заместители , которые могут приводить к стерическим эффектам .
Значения σ, представленные в таблице выше, демонстрируют определенные эффекты заместителей. При ρ = 1 группа заместителей с возрастающими положительными значениями, особенно циано и нитро , приводит к увеличению константы равновесия по сравнению с эталонным водородом, а это означает, что кислотность карбоновой кислоты (изображенной слева от уравнения) увеличилась. . Эти заместители стабилизируют отрицательный заряд карбоксилатного атома кислорода за счет электроноакцепторного индуктивного эффекта (-I), а также отрицательного мезомерного эффекта (-М).
Следующий набор заместителей — галогены , для которых эффект заместителя все еще положительный, но гораздо более скромный. Причина этого в том, что, хотя индуктивный эффект по-прежнему отрицателен, мезомерный эффект положителен, вызывая частичную отмену. Данные также показывают, что для этих заместителей мета-эффект намного больше, чем пара-эффект, из-за того, что мезомерный эффект значительно снижается в мета-заместителе. В случае метазаместителей атом углерода, несущий отрицательный заряд, находится дальше от группы карбоновой кислоты (структура 2б).
Этот эффект изображен на схеме 3 , где в паразамещенном арене 1a одна резонансная структура 1b представляет собой хиноид с положительным зарядом на заместителе X, высвобождающим электроны и, таким образом, дестабилизирующим заместитель Y. Этот дестабилизирующий эффект невозможен, когда X имеет метаориентацию.

Другие заместители, такие как метокси и этокси , могут даже иметь противоположные знаки константы заместителя в результате противоположного индуктивного и мезомерного эффекта. Только алкильные и арильные заместители, такие как метил , отдают электроны в обоих отношениях.
Конечно, когда знак константы реакции отрицательный (следующий раздел), только заместители с такой же отрицательной константой заместителя будут увеличивать константы равновесия.
Поскольку карбонильная группа не может служить источником электронов для групп -M (в отличие от доноров неподеленных пар, таких как OH), для реакций с участием исходных веществ фенола и анилина значения σ p для электроноакцепторных групп окажутся слишком маленькими. Для реакций, где ожидается, что резонансные эффекты будут иметь большое влияние, лучше подойдет модифицированный параметр и модифицированный набор констант σ p – . Этот параметр определяется с использованием констант ионизации паразамещенных фенолов с помощью масштабного коэффициента для согласования значений σ p – со значениями σ p для «неаномальных» заместителей, чтобы поддерживать сопоставимые значения ρ: для ArOH ⇄ ArO – + H + , определим .
Аналогично, карбонильный углерод бензойной кислоты находится в узловом положении и не может служить поглотителем групп +M (в отличие от карбокатиона в бензильном положении). Таким образом, для реакций с участием карбокатионов в α-положении значения σ p для электронодонорных групп окажутся недостаточно отрицательными. Исходя из аналогичных соображений, набор констант σ p + лучше подходит для реакций с участием электронодонорных групп в пара- положении и образования карбокатиона в бензильном центре. Значения σ p + основаны на константах скорости реакции S N 1 кумилхлоридов в 90% ацетон/вода: для ArCMe 2 Cl + H 2 O → ArCMe 2 OH + HCl определяем . Обратите внимание, что масштабный коэффициент отрицателен, поскольку электронодонорная группа ускоряет реакцию. Для реакции, для которой строится график Гаммета, возможно, потребуется проверить эти альтернативные константы Гаммета, чтобы увидеть, можно ли получить лучшую линейность.
Зная константы заместителей, теперь можно получить константы реакций для широкого круга органических реакций . Типичная реакция — щелочной гидролиз этилбензоата (R=R'=H ) в смеси воды и этанола при 30 °C. Измерение скорости реакции k 0 в сочетании со скоростью реакции многих замещенных этилбензоатов в конечном итоге приводит к константе реакции +2,498. [3] [ требуется обновление ] [ необходим неосновной источник ]

Константы реакций известны для многих других реакций и равновесий. Вот подборка из тех, что предоставил сам Хэммет (их значения указаны в скобках):
Константа реакции или константа чувствительности ρ описывает восприимчивость реакции к заместителям по сравнению с ионизацией бензойной кислоты. Это эквивалентно наклону графика Хэммета. Информацию о реакции и связанном с ней механизме можно получить на основе полученного значения ρ . Если значение:
Эти соотношения можно использовать для выяснения механизма реакции. Поскольку значение ρ связано с зарядом на этапе определения скорости, на основе этой информации можно разработать механизмы. Если считается, что реакция ароматического соединения происходит по одному из двух механизмов, соединение можно модифицировать с помощью заместителей с разными значениями σ и провести кинетические измерения. После проведения этих измерений можно построить график Хэммета для определения значения ρ . Если один из этих механизмов предполагает образование заряда, это можно проверить по значению ρ. И наоборот, если график Хэммета показывает, что заряд не образуется, т. е. наклон равен нулю, то механизм, включающий образование заряда, можно отбросить.
Графики Хэммета не всегда могут быть идеально линейными. Например, кривая может показывать внезапное изменение наклона или значения ρ . В таком случае вполне вероятно, что механизм реакции изменится при добавлении другого заместителя. Другие отклонения от линейности могут быть связаны с изменением положения переходного состояния. В такой ситуации определенные заместители могут привести к более раннему (или позднему) появлению переходного состояния в механизме реакции. [7] [ нужна страница ]
Преобладают 3 вида основного состояния или статических электрических воздействий:
Последние два влияния часто рассматриваются вместе как составной эффект, но здесь рассматриваются отдельно. Вестхаймер продемонстрировал, что электрические эффекты π-замещенных диполярных групп на кислотность бензойной и фенилуксусной кислот могут быть количественно коррелированы, если предположить только прямое электростатическое действие заместителя на ионизируемый протон карбоксильной группы . Лечение Вестхаймера сработало хорошо, за исключением тех кислот с заместителями, которые имеют неподеленные электронные пары, такие как –OH и –OCH3, поскольку эти заместители сильно взаимодействуют с бензольным кольцом. [8] [ необходим неосновной источник ] [ необходим неосновной источник ] [9] [ необходим неосновной источник ] [ требуется обновление ] [ необходим неосновной источник ]
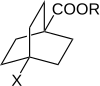
Робертс и Морленд изучили реакционную способность 4-замещенных бицикло[2.2.2]октан-1-карбоновых кислот и их эфиров. В такой молекуле передача электрических эффектов заместителей через кольцо путем резонанса невозможна. Следовательно, это намекает на роль π-электронов в передаче эффектов заместителя через ароматические системы . [10] [ необходим неосновной источник ] [ необходим неосновной источник ]
Реакционная способность 4-замещенных бицикло[2.2.2]октан-1-карбоновых кислот и их эфиров измерялась в трех различных процессах, каждый из которых ранее использовался с производными бензойной кислоты. График зависимости log(k) от log(K A ) показал линейную зависимость. Такие линейные зависимости соответствуют линейным соотношениям свободной энергии, из которых следует, что влияние заместителей осуществляется за счет изменений потенциальной энергии и что стерические и энтропийные члены остаются почти постоянными на протяжении всего ряда. Линейная зависимость хорошо вписывается в уравнение Хэммета. Для 4-замещенных производных бицикло[2.2.2.]октан-1-карбоновой кислоты заместитель и константы реакции обозначены σ' и ρ'.
Данные по реакционной способности показывают, что влияние групп-заместителей при определении реакционной способности замещенных бензойных и бицикло[2.2.2.]октан-1-карбоновых кислот сопоставимо. Это означает, что ароматические π-электроны не играют доминирующей роли в передаче электрических эффектов диполярных групп на ионизируемую карбоксильную группу. Разница между ρ и ρ' для реакций кислот с дифенилазометаном, вероятно, обусловлена обратной зависимостью от диэлектрическая проницаемость растворителя D e
Для метанаправляющих групп ( электроноакцепторная группа или ЭВГ ) σ мета и σ пара более положительны, чем σ'. (Верхний индекс c в таблице обозначает данные Hammett, 1940. [11] [ нужна страница ] ) Для орто-пара-направляющих групп ( электронодонорной группы или EDG ) σ' более положителен, чем σ мета и σ para . Разница между σ пара и σ' (σ пара – σ') больше, чем разница между σ мета и σ' (σ мета - σ'). Это ожидаемо, поскольку эффекты электронного резонанса сильнее ощущаются в p-положениях. Значения (σ – σ') можно принять в качестве разумного измерения резонансных эффектов.
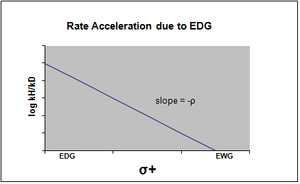
График уравнения Гаммета обычно рассматривается как линейный, с положительным или отрицательным наклоном, коррелирующим со значением rho. Однако на графике Гаммета возникает нелинейность, когда заместитель влияет на скорость реакции или изменяет скорость определяющую стадию или механизм реакции . По причине первого случая были введены новые сигма-константы, чтобы учесть отклонение от линейности, которое в противном случае наблюдалось бы в результате влияния заместителя. σ+ учитывает накопление положительного заряда, происходящее в переходном состоянии реакции. Следовательно, электронодонорная группа (EDG) ускорит скорость реакции за счет резонансной стабилизации и даст следующий сигма-график с отрицательным значением ро. [12] [ необходим неосновной источник ] [ необходим неосновной источник ]
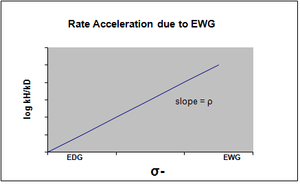
σ- обозначается в случае, когда происходит накопление отрицательного заряда в переходном состоянии и, следовательно, скорость реакции ускоряется электроноакцепторными группами (ЭРГ). EWG удаляет электронную плотность за счет резонанса и эффективно стабилизирует образующийся отрицательный заряд. Соответствующий график покажет положительное значение ро.
В случае нуклеофильного ацильного замещения влияние заместителя X неуходящей группы может фактически ускорить скорость реакции нуклеофильного присоединения, когда X представляет собой EWG. Это объясняется резонансным вкладом EWG в удаление электронной плотности, тем самым увеличивая восприимчивость к нуклеофильной атаке карбонильного углерода. Изменение скорости происходит, когда X представляет собой EDG, о чем свидетельствует сравнение скоростей между X = Me и X = OMe, а на графике Хэммета наблюдается нелинейность. [13] [ необходим неосновной источник ] [ необходим неосновной источник ]
Влияние заместителя может изменить скорость определяющую стадию (rds) в механизме реакции. Определенный электронный эффект может ускорить определенный шаг, и он перестанет быть РДС. [14] [ необходим неосновной источник ] [ необходим неосновной источник ]

Изменение механизма реакции также приводит к нелинейности графика Хэммета. Обычно в этом случае для измерения изменений скорости используется модель реакции SN2. [15] [ необходим непервичный источник ] [ необходим непервичный источник ] Однако было замечено, что в некоторых случаях реакции SN2 EWG не ускоряет реакцию, как ожидалось [16] [ непервичный источник необходим источник ] [ необходим неосновной источник ] и что скорость варьируется в зависимости от заместителя. Фактически, в случае бензильной системы заместитель влияет на знак заряда и степень его развития. [15] [ нужен неосновной источник ]

Например, заместитель может определять механизм реакции типа SN1 по сравнению с реакцией типа SN2 , и в этом случае результирующий график Хэммета будет указывать на ускорение скорости из-за EDG, тем самым поясняя механизм реакции.
Еще одно отклонение от регулярного уравнения Гаммета объясняется зарядом нуклеофила. [15] [ необходим неосновной источник ] Несмотря на нелинейность реакций бензила SN2, электроноакцепторные группы могут либо ускорять, либо замедлять реакцию. Если нуклеофил заряжен отрицательно (например, цианид), электроноакцепторная группа увеличит скорость из-за стабилизации дополнительного заряда, который переносится на углерод в переходном состоянии. С другой стороны, если нуклеофил не заряжен (например, трифенилфосфин), электроноакцепторная группа будет замедлять реакцию за счет уменьшения электронной плотности на антисвязывающей орбитали уходящей группы в переходном состоянии.
В настоящее время существуют другие уравнения, которые уточняют исходное уравнение Гаммета: уравнение Суэйна-Луптона , [ нужна ссылка ] уравнение Тафта , [ нужна ссылка ] уравнение Грюнвальда -Винштейна , [ нужна ссылка ] и уравнение Юкавы-Цуно . [ нужна цитация ] Также было разработано уравнение, которое учитывает стереохимию в алифатических системах. [ неопределенно ] [17] [ необходим неосновной источник ] [ необходим неосновной источник ]

Сдвиги энергии связи остова-электрона (CEBE) линейно коррелируют с константами заместителей Гаммета ( σ ) в замещенных производных бензола . [18] [ нужен неосновной источник ]
Рассмотрим пара-дизамещенный бензол pFC 6 H 4 -Z, где Z представляет собой заместитель, такой как NH 2 , NO 2 и т.д. Атом фтора является пара-по отношению к заместителю Z в бензольном кольце. На изображении справа показаны четыре выделенных кольцевых атома углерода: C1( ipso ), C2( орто ), C3( мета ), C4( пара ) в молекуле pFC 6 H 4 -Z. Углерод с Z определяется как C1(ipso), а фторированный углерод как C4(para). Это определение соблюдается даже для Z = H. Левая часть ( 1 ) называется сдвигом CEBE или ΔCEBE и определяется как разница между CEBE фторированного атома углерода в pFC 6 H 4 -Z и фторированный углерод в эталонной молекуле FC 6 H 5 .
Правая часть уравнения. 1 представляет собой произведение параметра κ и константы заместителя Гаммета в пара-положении σp . Параметр κ определяется уравнением. 3 :
где ρ и ρ * — константы реакции Гаммета для реакции нейтральной молекулы и остовной ионизированной молекулы соответственно. ΔCEBE кольцевых атомов углерода в pFC 6 H 4 -Z были рассчитаны с помощью теории функционала плотности , чтобы увидеть, как они коррелируют с σ-константами Гаммета. Линейные графики были получены, когда рассчитанные сдвиги CEBE в орто-, мета- и парауглероде были построены в зависимости от констант Гаммета σ o , σ m и σ p соответственно.
Отсюда приблизительное согласие по численному значению и знаку между сдвигами CEBE и соответствующей им константой Гаммета σ . [19] [ необходим неосновной источник ] [ необходим неосновной источник ]