Уропорфириноген III — тетрапиррол , первый макроциклический промежуточный продукт в биосинтезе гема , хлорофилла , витамина В12 и сирогема . Это бесцветное соединение, как и другие порфириногены . [1]
Молекулярную структуру уропорфириногена III можно описать как гексагидропорфиновое ядро, где в каждом пиррольном кольце атомы водорода на двух крайних атомах углерода заменены группой уксусной кислоты ( -CH 2 -COOH , «A») и группой пропионовой кислоты ( −CH 2 −CH 2 −COOH , «P»). Группы прикреплены асимметрично: по макроциклу порядок АП-АП-АП-ПА.
В общем пути биосинтеза порфиринов уропорфириноген III образуется из линейного тетрапиррольного преуропорфириногена (замещенного гидроксиметилбилана ) под действием фермента уропорфириноген-III-косинтазы . [2] [3]
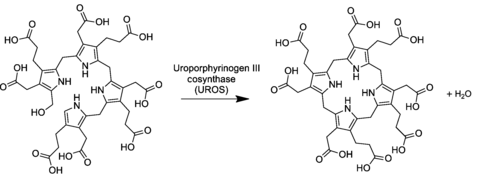
Преобразование влечет за собой изменение местами последней пиррольной единицы (таким образом, заменяя группы уксусной и пропионовой кислоты) и реакцию конденсации , которая замыкает макроцикл путем отщепления конечного гидроксила -OH атомом водорода первого кольца.
При биосинтезе гема и хлорофиллов уропорфириноген III превращается в копропорфириноген III под действием фермента декарбоксилазы уропорфириногена III . При биосинтезе сирогемов уропорфириноген III преобразуется двумя метилтрансферазами в дигидросирогемы , который впоследствии окисляется сирогидрохлорином , предшественником простетической группы сирогемов .
Если синтаза уропорфириноген-III отсутствует или неактивна, гидроксиметилбилан спонтанно циклизуется в структурный изомер уропорфириноген I , который отличается от изомера III тем, что группы уксусной кислоты («А») и пропионовой кислоты («Р») расположены во вращательно-симметричном порядке AP-AP-AP-AP. В этом случае на следующем этапе вырабатывается копропорфириноген I , который накапливается, что приводит к патологическому состоянию врожденной эритропоэтической порфирии [3]