Фениллитий — металлоорганический агент с эмпирической формулой C6H5Li . Он чаще всего используется в качестве металлирующего агента в органических синтезах и заменителя реактивов Гриньяра для введения фенильных групп в органических синтезах. [3] Кристаллический фениллитий бесцветен; однако растворы фениллития имеют различные оттенки коричневого или красного цвета в зависимости от используемого растворителя и примесей, присутствующих в растворенном веществе. [4]
Фениллитий был впервые получен реакцией металлического лития с дифенилртутью : [5]
Реакция фенилгалогенида с металлическим литием приводит к образованию фениллития:
Фениллитий также можно синтезировать с помощью реакции обмена металла с галогеном:
В настоящее время преобладающими методами получения фениллития являются два последних синтеза.
Основное применение PhLi — облегчение образования углерод-углеродных связей посредством реакций нуклеофильного присоединения и замещения:
2-Фенилпиридин получают путем реакции фениллития с пиридином, процесс, включающий путь присоединения-элиминирования: [6]
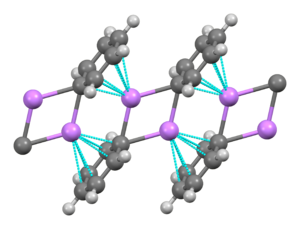
Фениллитий — это литийорганическое соединение, которое образует моноклинные кристаллы. Твердый фениллитий можно описать как состоящий из димерных субъединиц Li 2 Ph 2 . Атомы Li и ипсо- углероды фенильных колец образуют плоское четырехчленное кольцо. Плоскость фенильных групп перпендикулярна плоскости этого кольца Li 2 C 2 . Дополнительная сильная межмолекулярная связь возникает между этими димерами фениллития и π-электронами фенильных групп в соседних димерах, что приводит к бесконечной полимерной лестничной структуре. [7]
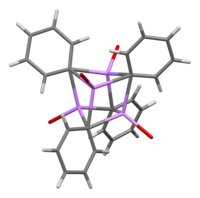
В растворе он принимает различные структуры в зависимости от органического растворителя. В тетрагидрофуране он уравновешивается между мономерным и димерным состояниями. В эфире, в котором он обычно продается, фениллитий существует в виде тетрамера. Четыре атома Li и четыре ипсо углеродных центра занимают чередующиеся вершины искаженного куба. Фенильные группы находятся на гранях тетраэдра и связываются с тремя ближайшими атомами Li.
Длины связей C–Li составляют в среднем 2,33 Å. Молекула эфира связывается с каждым из участков Li через свой атом кислорода. В присутствии LiBr, побочного продукта прямой реакции лития с фенилгалогенидом, комплекс [(PhLi•Et 2 O) 4 ] вместо этого становится [(PhLi•Et 2 O) 3 •LiBr]. Атом Li в LiBr занимает один из литиевых участков в кластере кубанового типа , а атом Br находится в соседнем углеродном участке. [8]