
При атмосферном давлении существуют три аллотропные формы железа в зависимости от температуры: альфа-железо (α-Fe, феррит) , гамма-железо (γ-Fe, аустенит) и дельта-железо (δ-Fe). При очень высоком давлении существует четвертая форма, эпсилон-железо (ε-Fe, гексаферрум) . Некоторые противоречивые экспериментальные данные свидетельствуют о существовании пятой формы высокого давления, которая стабильна при очень высоких давлениях и температурах. [1]
Фазы железа при атмосферном давлении важны из-за различий в растворимости углерода , образуя различные типы стали . Фазы железа высокого давления важны как модели для твердых частей планетных ядер. Внутреннее ядро Земли , как правило, состоит в основном из кристаллического железоникелевого сплава со структурой ε. [2] [3] [4] Считается, что внешнее ядро, окружающее твердое внутреннее ядро, состоит из жидкого железа, смешанного с никелем и следовыми количествами более легких элементов.
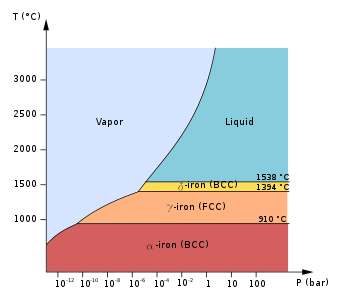
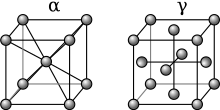
Ниже 912 °C (1674 °F) железо имеет объемно-центрированную кубическую (ОЦК) кристаллическую структуру и известно как α-железо или феррит . Это термодинамически стабильный и довольно мягкий металл. α-Fe может подвергаться давлению до ок. 15 ГПа, прежде чем превратиться в форму высокого давления, называемую ε-Fe, обсуждаемую ниже.
С точки зрения магнитных свойств, α-железо является парамагнитным при высоких температурах. Однако ниже своей температуры Кюри ( T C или A 2 ) 771 °C (1044 K или 1420 °F) [5] оно становится ферромагнитным . В прошлом парамагнитная форма α-железа была известна как бета-железо (β-Fe). [6] [7] Несмотря на то, что небольшое тетрагональное искажение в ферромагнитном состоянии действительно представляет собой истинный фазовый переход, непрерывный характер этого перехода приводит лишь к незначительному значению при термообработке стали . Линия A 2 образует границу между полями бета-железа и альфа на фазовой диаграмме на рисунке 1.
Аналогично граница A 2 имеет лишь второстепенное значение по сравнению с критическими температурами A 1 ( эвтектоид ), A 3 и A cm . A cm , где аустенит находится в равновесии с цементитом + γ-Fe, находится за правым краем на рис. 1. Поле фаз α + γ технически является полем β + γ выше A 2 . Обозначение бета сохраняет непрерывность греческой буквенной прогрессии фаз в железе и стали: α-Fe, β-Fe, аустенит (γ-Fe), высокотемпературное δ-Fe и гексаферрум высокого давления (ε-Fe).

Первичная фаза низкоуглеродистой или мягкой стали и большинства чугунов при комнатной температуре — ферромагнитное α-Fe. [8] [9] Он имеет твердость приблизительно 80 по Бринеллю . [10] [11] Максимальная растворимость углерода составляет около 0,02% по весу при 727 °C (1341 °F) и 0,001% при 0 °C (32 °F). [12] Когда он растворяется в железе, атомы углерода занимают междоузлия «отверстия». Будучи примерно в два раза больше диаметра тетраэдрического отверстия , углерод вносит сильное локальное поле деформации.
Мягкая сталь (углеродистая сталь с содержанием углерода до 0,2 мас.%) в основном состоит из α-Fe и увеличивающегося количества цементита (Fe3C , карбида железа). Смесь принимает пластинчатую структуру, называемую перлитом . Поскольку бейнит и перлит содержат α-Fe в качестве компонента, любой железоуглеродистый сплав будет содержать некоторое количество α-Fe, если ему дать достичь равновесия при комнатной температуре. Количество α-Fe зависит от процесса охлаждения.

β-Fe и критическая температура A 2 важны при индукционном нагреве стали, например, для поверхностной закалки. Сталь обычно аустенизируется при 900–1000 °C перед закалкой и отпуском . Высокочастотное переменное магнитное поле индукционного нагрева нагревает сталь двумя механизмами ниже температуры Кюри: сопротивлением или джоулевым нагревом и ферромагнитными гистерезисными потерями. Выше границы A 2 механизм гистерезиса исчезает, и требуемое количество энергии на градус повышения температуры, таким образом, существенно больше, чем ниже A 2 . Для изменения импеданса в источнике индукционной мощности с целью компенсации изменения могут потребоваться схемы согласования нагрузки . [13]
При нагревании железа выше 912 °C (1674 °F) его кристаллическая структура меняется на гранецентрированную кубическую (ГЦК) кристаллическую структуру. В этой форме оно называется гамма-железом (γ-Fe) или аустенитом . γ-железо может растворять значительно больше углерода (до 2,04% по массе при 1146 °C). Эта γ-форма насыщения углеродом проявляется в аустенитной нержавеющей стали .
Примечательно, что при температуре выше 1394 °C (2541 °F) железо возвращается в структуру ОЦК, известную как δ-Fe. [14] δ-железо может растворять до 0,08% углерода по массе при 1475 °C. Оно стабильно вплоть до точки плавления 1538 °C (2800 °F). δ-Fe не может существовать выше 5,2 ГПа, а аустенит вместо этого переходит непосредственно в расплавленную фазу при этих высоких давлениях. [15]
При давлении выше примерно 10-13 ГПа и температуре до примерно 700 К α-железо переходит в гексагональную плотноупакованную (ГПУ) структуру, которая также известна как ε-железо или гексаферрум; [16] более высокотемпературная γ-фаза также переходит в ε-железо, но обычно требует гораздо более высоких давлений по мере повышения температуры. Тройная точка гексаферрума, феррита и аустенита составляет 10,5 ГПа при 750 К. [15] Наблюдался антиферромагнетизм в сплавах эпсилон-Fe с Mn, Os и Ru. [17]
Альтернативная стабильная форма, если она существует, может появиться при давлении не менее 50 ГПа и температуре не менее 1500 К; считалось, что она имеет орторомбическую или двойную ГПУ-структуру. [1] По состоянию на декабрь 2011 года [обновлять]проводились недавние и продолжающиеся эксперименты с аллотропами углерода высокого давления и сверхплотности .
Температура плавления железа экспериментально хорошо определена для давлений менее 50 ГПа.
Для более высоких давлений опубликованные данные (по состоянию на 2007 год) помещают тройную точку γ-ε-жидкости при давлениях, которые отличаются на десятки гигапаскалей и 1000 К в точке плавления. Вообще говоря, молекулярно-динамическое компьютерное моделирование плавления железа и эксперименты с ударной волной предполагают более высокие температуры плавления и гораздо более крутой наклон кривой плавления, чем статические эксперименты, проведенные в ячейках с алмазными наковальнями . [18]
Температуры плавления и кипения железа, а также его энтальпия атомизации , ниже, чем у более ранних элементов 3d группы от скандия до хрома , что показывает уменьшенный вклад 3d-электронов в металлическую связь, поскольку они все больше и больше притягиваются ядром в инертное ядро ; [ 19] однако, они выше, чем значения для предыдущего элемента марганца, поскольку этот элемент имеет наполовину заполненную 3d-подоболочку и, следовательно, его d-электроны нелегко делокализованы . Та же тенденция наблюдается для рутения, но не для осмия . [20]
Точные температуры, при которых железо перейдет из одной кристаллической структуры в другую, зависят от того, сколько и какой тип других элементов растворены в железе. Фазовая граница между различными твердыми фазами нарисована на бинарной фазовой диаграмме , обычно отображаемой как температура против процента железа. Добавление некоторых элементов, таких как хром , сужает температурный диапазон для гамма-фазы, в то время как другие увеличивают температурный диапазон гамма-фазы. В элементах, которые уменьшают диапазон гамма-фазы, граница альфа-гамма-фазы соединяется с границей гамма-дельта-фазы, образуя то, что обычно называют гамма-петлей . Добавление добавок гамма-петли сохраняет железо в объемно-центрированной кубической структуре и предотвращает фазовый переход стали в другие твердые состояния. [21]