Фосфатидовые кислоты — это анионные фосфолипиды, важные для клеточной сигнализации и прямой активации липид-зависимых ионных каналов . Гидролиз фосфатидовой кислоты приводит к образованию одной молекулы глицерина и фосфорной кислоты и двух молекул жирных кислот. Они составляют около 0,25% фосфолипидов в бислое. [1]

Фосфатидная кислота состоит из глицеринового остова, в котором, как правило, насыщенная жирная кислота связана с углеродом -1, ненасыщенная жирная кислота связана с углеродом -2, а фосфатная группа связана с углеродом -3. [2] [3]
Помимо синтеза de novo, ПА может образовываться тремя способами:
Путь глицерол-3-фосфата для синтеза PA de novo показан здесь:
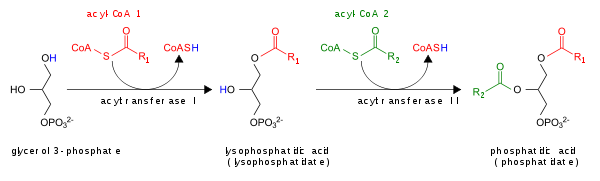
Кроме того, PA может быть преобразован в DAG с помощью липидфосфатфосфогидролаз (LPP) [6] [7] или в лизо-PA с помощью фосфолипазы A (PLA).
Роль ПА в клетке можно разделить на три категории:
Первые три роли не являются взаимоисключающими. Например, PA может участвовать в формировании везикул, способствуя искривлению мембраны и привлекая белки для выполнения гораздо более энергетически невыгодной задачи формирования шейки и сдавливания.
PA является жизненно важным клеточным липидом, который действует как биосинтетический предшественник для образования (прямо или косвенно) всех ацилглицериновых липидов в клетке. [11]
В клетках млекопитающих и дрожжей известны два различных пути синтеза PA de novo, путь глицерол-3-фосфата или путь дигидроксиацетонфосфата. У бактерий присутствует только первый путь, и мутации, которые блокируют этот путь, летальны, что демонстрирует важность PA. В клетках млекопитающих и дрожжей, где ферменты в этих путях избыточны, мутация любого одного фермента не летальна. Однако стоит отметить, что in vitro различные ацилтрансферазы проявляют различную субстратную специфичность в отношении ацил-КоА, которые включены в PA. Различные ацилтрансферазы также имеют различное внутриклеточное распределение, такое как эндоплазматический ретикулум (ЭР), митохондрии или пероксисомы, и локальные концентрации активированных жирных кислот. Это говорит о том, что различные ацилтрансферазы, присутствующие в клетках млекопитающих и дрожжей, могут быть ответственны за выработку различных пулов PA. [11]
Превращение PA в диацилглицерол (DAG) с помощью LPP является шагом, обеспечивающим производство фосфатидилхолина (PC), фосфатидилэтаноламина (PE) и фосфатидилсерина (PS). Кроме того, DAG также преобразуется в CDP-DAG, который является предшественником фосфатидилглицерола (PG), фосфатидилинозитола (PI) и фосфоинозитидов (PIP, PIP 2 , PIP 3 ). [11]
Концентрации PA поддерживаются на крайне низком уровне в клетке за счет активности мощных LPP. [6] Они очень быстро превращают PA в DAG, и поскольку DAG является предшественником для многих других липидов, он также вскоре метаболизируется в другие мембранные липиды. Это означает, что любое повышение регуляции в производстве PA может быть сопоставлено с течением времени с соответствующим повышением регуляции в LPP и в ферментах, метаболизирующих DAG.
Таким образом, ПА необходим для синтеза липидов и выживания клеток, однако в нормальных условиях его уровень в клетке поддерживается на очень низком уровне.
PA является уникальным фосфолипидом, поскольку имеет небольшую высокозаряженную головную группу, которая находится очень близко к глицериновому остову. Известно, что PA играет роль как в делении везикул [12] , так и в слиянии [13] , и эти роли могут быть связаны с биофизическими свойствами PA.
В местах почкования или слияния мембраны мембрана становится или является сильно изогнутой. Главным событием в почковании везикул, таких как транспортные переносчики из Гольджи , является создание и последующее сужение шейки мембраны. Исследования показали, что этот процесс может быть липидным, и постулировали центральную роль DAG из-за его, также уникальной молекулярной формы. Наличие двух ацильных цепей, но без головной группы, приводит к большой отрицательной кривизне в мембранах. [14]
LPAAT BARS-50 также участвует в почковании от аппарата Гольджи. [12] Это говорит о том, что превращение lysoPA в PA может влиять на кривизну мембраны. Активность LPAAT удваивает количество ацильных цепей, значительно увеличивая площадь поперечного сечения липида, который находится «внутри» мембраны, в то время как поверхностная головная группа остается неизменной. Это может привести к более отрицательной кривизне мембраны. Исследователи из Утрехтского университета изучили влияние lysoPA по сравнению с PA на кривизну мембраны, измерив их влияние на температуру перехода PE из липидных бислоев в неламеллярные фазы с помощью 31P -ЯМР. [15] Было показано, что кривизна, вызванная этими липидами, зависит не только от структуры lysoPA по сравнению с PA, но и от динамических свойств, таких как гидратация головных групп и меж- и внутримолекулярные взаимодействия. Например, Ca 2+ может взаимодействовать с двумя PA, образуя нейтральный, но сильно изогнутый комплекс. Нейтрализация в противном случае отталкивающих зарядов головных групп и отсутствие каких-либо стерических препятствий обеспечивает сильные межмолекулярные взаимодействия между ацильными цепями, что приводит к образованию микродоменов, богатых PA. Таким образом , in vitro физиологические изменения pH, температуры и концентрации катионов оказывают сильное влияние на кривизну мембраны, вызванную PA и lysoPA. [15] Взаимное превращение lysoPA, PA и DAG — и изменения pH и концентрации катионов — может вызывать изгиб и дестабилизацию мембраны, играя прямую роль в делении мембраны просто в силу своих биофизических свойств. Однако, хотя было показано, что PA и lysoPA влияют на кривизну мембраны in vitro , их роль in vivo неясна.
Роль lysoPA, PA и DAG в содействии изгибу мембраны не исключает их роль в привлечении белков к мембране. Например, потребность в Ca 2+ для слияния сложных липосом не сильно зависит от добавления аннексина I, хотя она снижается PLD. Однако с аннексином I и PLD степень слияния значительно увеличивается, а потребность в Ca 2+ снижается почти в 1000 раз до почти физиологических уровней. [13]
Таким образом, метаболическая, биофизическая, рекрутинговая и сигнальная роли ПА могут быть взаимосвязаны.
PA поддерживается на низком уровне в объеме мембраны для того, чтобы временно взорваться и сигнализировать локально в высокой концентрации. [16] Например, каналы TREK-1 активируются локальной ассоциацией с PLD и продукцией PA. [17] Константа диссоциации PA для TREK-1 составляет приблизительно 10 микромоль. [18] Относительно слабое связывание в сочетании с низкой концентрацией PA в мембране позволяет каналу выключаться. Локальная высокая концентрация для активации предполагает, по крайней мере, некоторые ограничения в локальной диффузии липидов. Объемная низкая концентрация PA в сочетании с высокими локальными выбросами является противоположностью сигнализации PIP2. PIP2 поддерживается на относительно высоком уровне в мембране, а затем временно гидролизуется вблизи белка для того, чтобы временно уменьшить сигнализацию PIP2. [19] Сигнализация PA отражает сигнализацию PIP2 в том, что объемная концентрация сигнального липида не должна меняться, чтобы оказать мощное локальное воздействие на целевой белок.
Как описано выше, PLD гидролизует PC с образованием PA и холина . Поскольку холин очень распространен в клетке, активность PLD не оказывает существенного влияния на уровень холина; и холин вряд ли будет играть какую-либо роль в передаче сигналов. [ необходима цитата ]
Роль активации PLD в многочисленных сигнальных контекстах в сочетании с отсутствием роли холина предполагает, что PA важен в передаче сигналов. Однако PA быстро преобразуется в DAG, а DAG также известен как сигнальная молекула. Это поднимает вопрос о том, играет ли PA какую-либо прямую роль в передаче сигналов или же он просто действует как предшественник для производства DAG. [20] [21] Если будет обнаружено, что PA действует только как предшественник DAG, то можно поднять вопрос о том, почему клетки должны производить DAG с использованием двух ферментов, когда они содержат PLC , который может производить DAG за один шаг.
PA, произведенный PLD или DAGK, можно отличить по добавлению [γ- 32 P]ATP. Это покажет, является ли фосфатная группа новым производным от активности киназы или она происходит от PC. [22]
Хотя PA и DAG взаимопревращаемы, они не действуют в одних и тех же путях. Стимулы, активирующие PLD, не активируют ферменты ниже DAG, и наоборот. Например, было показано, что добавление PLD к мембранам приводит к образованию PA, меченых [ 32P ], и фосфоинозитидов, меченых [ 32P ]. [23] Добавление ингибиторов DAGK устраняет образование PA, меченых [ 32P ], но не стимулирует PLD образование фосфоинозитидов.
Возможно, что, хотя PA и DAG взаимопревращаемы, могут поддерживаться отдельные пулы сигнальных и несигнальных липидов. Исследования показали, что сигнализация DAG опосредована полиненасыщенным DAG, тогда как PA, полученный из PLD, является мононенасыщенным или насыщенным. Таким образом, функциональный насыщенный/мононенасыщенный PA может быть деградирован путем гидролиза с образованием нефункционального насыщенного/мононенасыщенного DAG, тогда как функциональный полиненасыщенный DAG может быть деградирован путем преобразования его в нефункциональный полиненасыщенный PA. [20] [24]
Эта модель предполагает, что эффекторы PA и DAG должны быть способны различать липиды с одинаковыми головками, но с разными ацильными цепями. Хотя некоторые липидсвязывающие белки способны встраиваться в мембраны и гипотетически могут распознавать тип ацильной цепи или результирующие свойства мембраны, многие липидсвязывающие белки являются цитозольными и локализуются на мембране, связывая только головки липидов. Возможно, разные ацильные цепи могут влиять на угол головки в мембране. Если это так, то это предполагает, что домен связывания PA должен не только быть способен специфически связывать PA, но и должен быть способен идентифицировать те головки, которые находятся под правильным углом. Каким бы ни был механизм, такая специфичность возможна. Она наблюдается в DAGK семенников свиньи, которая специфична для полиненасыщенного DAG [25] , и в двух LPP гепатоцитов крысы, которые дефосфорилируют разные виды PA с разной активностью. [26] Более того, было показано, что стимуляция активности SK1 PS in vitro значительно варьируется в зависимости от того, использовались ли диолеоил (C18:1), дистеароил (C18:0) или 1-стеароил, 2-олеоил виды PS. [27] Таким образом, кажется, что, хотя PA и DAG являются взаимопревращаемыми, различные виды липидов могут иметь различную биологическую активность; и это может позволить двум липидам поддерживать отдельные сигнальные пути.
Поскольку PA быстро преобразуется в DAG, он очень недолговечен в клетке. Это означает, что трудно измерить выработку PA и, следовательно, изучить роль PA в клетке. Однако активность PLD можно измерить путем добавления первичных спиртов в клетку. [28] Затем PLD проводит реакцию трансфосфатидилирования вместо гидролиза, производя фосфатидиловые спирты вместо PA. Фосфатидиловые спирты являются метаболическими тупиками и могут быть легко извлечены и измерены. Таким образом, можно измерить активность PLD и выработку PA (если не саму PA), и, блокируя образование PA, можно сделать вывод об участии PA в клеточных процессах.