
Микробное сообщество гидротермальных жерл включает все одноклеточные организмы, которые живут и размножаются в химически отличной области вокруг гидротермальных жерл . К ним относятся организмы в микробном мате , свободно плавающие клетки или бактерии, находящиеся в эндосимбиотических отношениях с животными. Хемолитоавтотрофные бактерии получают питательные вещества и энергию в результате геологической активности гидротермальных источников, чтобы фиксировать углерод в органических формах. Вирусы также являются частью микробного сообщества гидротермальных источников, и их влияние на микробную экологию в этих экосистемах является развивающейся областью исследований. [1]
Гидротермальные источники расположены там, где тектонические плиты расходятся и расширяются. Это позволяет воде из океана проникать в земную кору, где она нагревается магмой. Растущее давление и температура вынуждают воду выходить из этих отверстий, на выходе вода накапливает растворенные минералы и химические вещества из пород, с которыми она сталкивается. Обычно встречаются три типа жерл, и все они характеризуются температурой и химическим составом. Диффузные вентиляционные отверстия выпускают чистую воду обычно с температурой до 30 °C. Вентиляционные отверстия для белых курильщиков выделяют воду молочного цвета при температуре 200–330 ° C, а вентиляционные отверстия для черных курильщиков обычно выделяют воду более горячую, чем другие вентиляционные отверстия, с температурой 300–400 ° C. Воды у черных курильщиков темнеют из-за накапливающихся осадков сульфидов. [2] Из-за отсутствия солнечного света на этих глубинах океана энергия обеспечивается хемосинтезом , при котором симбиотические бактерии и археи образуют нижнюю часть пищевой цепи и способны поддерживать различные организмы, такие как Riftia pachyptila и Alvinella pompejana. Эти организмы используют эти симбиотические отношения, чтобы использовать и получать химическую энергию, выделяющуюся в этих гидротермальных жерлах. [3]

Хотя существует большая разница температур на поверхности воды с сезонными изменениями глубины термоклина , температуры под термоклином и в водах вблизи глубокого моря относительно постоянны. Никакие изменения не вызваны сезонными эффектами или ежегодными изменениями. Эти температуры остаются в диапазоне 0–3 °C, за исключением вод, непосредственно окружающих гидротермальные источники, температура которых может достигать 407 °C. [4] [5] Эти воды не закипают из-за высокого давления на этих глубинах.
С увеличением глубины начинает действовать высокое давление. Давление увеличивается примерно на 10 мегапаскалей (МПа) на каждый километр вертикального расстояния. Это значит, что на глубине траншей гидростатическое давление может достигать 110 МПа. [6]
Соленость остается относительно постоянной в глубоких морях по всему миру и составляет 35 частей на тысячу. [4]
Хотя в среде гидротермальных жерл очень мало света, были обнаружены фотосинтезирующие организмы. [7] Однако энергия, которую использует большинство организмов, поступает в результате хемосинтеза. Организмы используют минералы и химические вещества, которые выходят из жерл.
Экстремальные условия в среде гидротермальных жерл означают, что микробным сообществам, населяющим эти районы, необходимо адаптироваться к ним. Известно, что обитающие здесь микробы — гипертермофилы — микроорганизмы, развивающиеся при температуре выше 90 °C. Эти организмы встречаются там, где жидкости из вентиляционных отверстий выбрасываются и смешиваются с окружающей водой. Считается, что эти гипертермофильные микробы содержат белки, которые обладают повышенной стабильностью при более высоких температурах благодаря внутримолекулярным взаимодействиям, но точные механизмы пока не ясны. Механизмы стабилизации ДНК не так уж неизвестны, и считается, что денатурация ДНК сводится к минимуму за счет высоких концентраций солей, в частности Mg, K и PO4, которые высоко сконцентрированы у гипертермофилов. Наряду с этим, у многих микробов есть белки, похожие на гистоны, которые связаны с ДНК и могут обеспечить защиту от высоких температур. Также обнаружено, что микробы находятся в симбиотических отношениях с другими организмами в среде гидротермальных жерл из-за их способности иметь механизм детоксикации, который позволяет им метаболизировать богатые сульфидами воды, которые в противном случае были бы токсичными для организмов и микробов. [8]
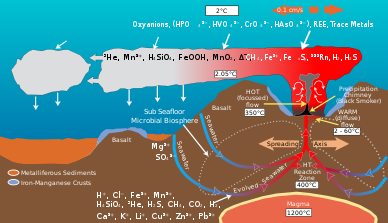
Микробные сообщества гидротермальных источников способствуют преобразованию энергии и минералов, образующихся в результате геологической деятельности, в органический материал . Органические вещества, вырабатываемые автотрофными бактериями, затем используются для поддержания верхних трофических уровней . Гидротермальная жерла и окружающая океанская вода богаты такими элементами, как железо , марганец и различные виды серы, включая сульфиды , сульфиты , сульфаты и элементарную серу , из которых они могут получать энергию или питательные вещества. [9] Микробы получают энергию, окисляя или восстанавливая элементы. Различные виды микробов используют разные химические виды элемента в своих метаболических процессах. Например, некоторые виды микробов окисляют сульфид до сульфата, а другие виды восстанавливают сульфат до элементарной серы. В результате сеть химических путей, опосредованных различными видами микробов, преобразует такие элементы, как углерод, сера, азот и водород, из одного вида в другой. Их активность изменяет первоначальный химический состав, возникший в результате геологической активности среды гидротермальных жерл. [10]
Геологическая деятельность в гидротермальных источниках приводит к обилию соединений углерода . [11] Шлейфы гидротермальных источников содержат высокие концентрации метана и угарного газа, причем концентрация метана в 10 7 раз превышает концентрацию окружающей океанской воды. [11] [12] Глубоководные океанские воды также являются большим резервуаром углерода, а концентрация таких видов углекислого газа, как растворенный CO 2 и HCO 3 , составляет около 2,2 мМ. [13] Обильные акцепторы углерода и электронов, образовавшиеся в результате геологической деятельности, поддерживают оазис хемоавтотрофных микробных сообществ, которые фиксируют неорганический углерод, такой как CO 2 , используя энергию из таких источников, как окисление серы, железа, марганца, водорода и метана. [11] Эти бактерии поставляют большую часть органического углерода, который поддерживает гетеротрофную жизнь в гидротермальных источниках. [14]
Фиксация углерода – это включение неорганического углерода в органическое вещество. В отличие от поверхности планеты, где свет является основным источником энергии для фиксации углерода, хемолитотрофные бактерии гидротермальных источников полагаются на химическое окисление для получения необходимой энергии. [15] Фиксация CO 2 наблюдается у представителей Gammaproteobacteria , Campylobacterota , Alphaproteobacteria и членов домена Archaea в гидротермальных источниках. Четыре основных метаболических пути фиксации углерода, обнаруженные в микробных сообществах жерл, включают цикл Кальвина-Бенсона-Бэсшама (CBB), цикл восстановительной трикарбоновой кислоты (rTCA), цикл 3-гидроксипропионата (3-HP) и восстановительный ацетилкоэнзим A (ацетил-КоА). ) путь. [15]
Цикл Кальвина-Бенсона-Башама (CBB) является наиболее распространенным путем фиксации CO2, обнаруженным среди автотрофов. [16] Ключевым ферментом является рибулозо-1,5-бисфосфаткарбоксилаза/оксигеназа ( RuBisCO ). [15] RuBisCO был идентифицирован у членов микробного сообщества, таких как Thiomicrospira, Beggiatoa , zetaproteobacterium и гаммапротеобактериальных эндосимбионтов трубчатых червей , двустворчатых моллюсков и брюхоногих моллюсков . [16]
Восстановительный цикл карбоновых кислот (rTCA) является вторым наиболее часто встречающимся путем фиксации углерода в гидротермальных источниках. [16] Цикл rTCA, по сути, представляет собой обращенный цикл TCA или цикл Кребса, который гетеротрофы используют для окисления органических веществ. Организмы, использующие цикл rTCA, предпочитают обитать в бескислородных зонах гидротермальной жерловой системы, поскольку некоторые ферменты цикла rTCA чувствительны к присутствию O 2. [15] Он обнаружен в сульфатредуцирующих дельтапротеобактериях , таких как некоторые представители Desulfobacter , Aquiificales. и Aquifex и Thermoproteales . [15]
Ключевыми ферментами циклов 3-HP и 3-HP/4-HB являются ацетил-КоА/пропионил-КоА-карбоксилаза, малонил-КоА-редуктаза и пропионил-КоА-синтаза. Большинство организмов, использующих этот путь, являются миксотрофами , способными использовать органический углерод в дополнение к фиксации углерода. [15]
Путь восстановительного ацетил-КоА обнаружен только у хемоавтотрофов. Этот путь не требует АТФ , поскольку он напрямую связан с восстановлением H 2 . Организмы, обнаруженные этим путем, предпочитают районы, богатые H 2 . Виды включают дельтапротеобактерии, такие как Dulfobacterium autotropicum, ацетогены и метаногенные археи . [15]
Гидротермальные источники производят большое количество метана , который может возникать как в результате геологических, так и биологических процессов. [11] [12] Концентрация метана в шлейфах гидротермальных жерл может превышать 300 мкм в зависимости от жерла. Для сравнения, жерловая жидкость содержит в 10 6 – 10 7 раз больше метана, чем окружающая глубоководная океанская вода, концентрация метана в которой колеблется от 0,2 до 0,3 нМ. [12] Микробные сообщества используют высокие концентрации метана в качестве источника энергии и источника углерода. [11] Метанотрофия , при которой вид использует метан как в качестве источника энергии, так и в качестве источника углерода, наблюдалась при наличии гаммапротеобактерий в линиях Mmethylococcaceae . [16] Метанотрофы преобразуют метан в углекислый газ и органический углерод. [12] Они обычно характеризуются наличием межклеточных мембран, и было замечено, что микробы с межклеточными мембранами составляют 20% микробного мата в гидротермальных источниках. [11] [12]
Производство энергии посредством окисления метана является следующим лучшим источником энергии после окисления серы. [11] Было высказано предположение, что микробное окисление способствует быстрому круговороту метана в гидротермальных источниках, поэтому большая часть метана окисляется на небольшом расстоянии от источника. [12] В гидротермальных жерловых сообществах аэробное окисление метана обычно обнаруживается у эндосимбиотических микробов жерловых животных. [17] Анаэробное окисление метана (АОМ) обычно сочетается с восстановлением сульфата или Fe и Mn в качестве терминальных акцепторов электронов, поскольку их больше всего в гидротермальных источниках. [12] [18] Обнаружено, что АОМ преобладает в морских отложениях гидротермальных жерл [19] [18] и может быть ответственным за потребление 75% метана, производимого жерлами. [18] Виды, которые выполняют АОМ, включают Archaea типа Thermoproteota (ранее Crenarchaeota ) и Thermococcus . [20]
Производство метана посредством метаногенеза может происходить в результате разложения углеводородов , реакции углекислого газа или других соединений, таких как формиат . [17] Свидетельства метаногенеза можно найти рядом с АОМ в отложениях. [19] Установлено, что термофильные метаногены растут в шлейфах гидротермальных жерл при температуре от 55 °C до 80 °C. [21] Однако автотропный метаногенез, осуществляемый многими термофильными видами, требует H 2 в качестве донора электронов, поэтому рост микробов ограничивается доступностью H 2 . [21] [14] Роды термофильных метаногенов, обнаруженных в гидротермальных источниках, включают Methanocaldococcus , Methanothermococcus и Methanococcus . [21]

Микробные сообщества гидротермальных источников преобразуют серу, такую как H 2 S , образующуюся в результате геологической деятельности, в другие формы, такие как сульфит , сульфат и элементарную серу, для получения энергии или ассимиляции в органические молекулы . [10] Сульфида много в гидротермальных источниках, его концентрация составляет от одного до десятков мМ, тогда как окружающая океанская вода обычно содержит лишь несколько наномолярей. [22]
Восстановленные соединения серы, такие как H 2 S, образующиеся в гидротермальных источниках, являются основным источником энергии для метаболизма серы у микробов. [11] Окисление восстановленных соединений серы в такие формы, как сульфит , тиосульфат и элементарная сера, используется для производства энергии для микробного метаболизма, например, для синтеза органических соединений из неорганического углерода . [10] Основные метаболические пути, используемые для окисления серы, включают путь SOX и диссимиляционное окисление. Путь Sox представляет собой мультиферментный путь, способный окислять сульфид, сульфит, элементарную серу и тиосульфат до сульфата. [10] Диссимиляционное окисление превращает сульфит в элементарную серу. [9] К видам, окисляющим серу , относятся роды Thiomicrospira , Halothiobacillus , Beggiatoa , Persephonella и Sulfurimonas . Симбиотические виды класса Gammaproteobacteria и филмы Campylobacterota также могут окислять серу. [10]
При восстановлении серы сульфат используется в качестве акцептора электронов для ассимиляции серы . Микробы, выполняющие сульфатредукцию, обычно используют водород , метан или органические вещества в качестве донора электронов . [18] [23] Анаэробное окисление метана (АОМ) часто использует сульфат в качестве акцептора электронов. [18] Этот метод предпочитают организмы, живущие в сильно бескислородных районах гидротермальных источников, [23] таким образом, это один из преобладающих процессов, которые происходят в отложениях. [14] Виды, восстанавливающие сульфат, были идентифицированы у архей и представителей дельтапротеобактерий , таких как Desulfovibrio , Desulfobulbus , Desulfobacteria и Desulfuromonas , в гидротермальных источниках. [23]

Глубокие океанские воды содержат самый большой резервуар азота , доступный для гидротермальных источников, с содержанием растворенного газообразного азота около 0,59 ммоль. [24] [25] Аммоний является доминирующим видом растворенного неорганического азота и может производиться путем смешивания водной массы под гидротермальными жерлами и сбрасывания в жерловые жидкости. [25] Количество доступного аммония варьируется в зависимости от жерл в зависимости от геологической активности и микробного состава. [25] Концентрация нитратов и нитритов в гидротермальных жерлах снижается по сравнению с окружающей морской водой. [24]
Изучение цикла азота в микробных сообществах гидротермальных источников по-прежнему требует более комплексных исследований. [24] Однако изотопные данные показывают, что микроорганизмы влияют на количество и состав растворенного неорганического азота, и все пути азотного цикла, вероятно, могут быть обнаружены в гидротермальных источниках. [25] Биологическая фиксация азота важна для обеспечения некоторого количества биологически доступного азота в азотном цикле, особенно в неосадочных гидротермальных источниках. [24] Азот фиксируется множеством различных микробов, включая метаноген из отрядов Methanomirobiales , Methanococcales и Methanobacteriales . [24] Было обнаружено, что термофильные микробы способны фиксировать азот при более высоких температурах, например, 92 °C. [24] Фиксация азота может быть особенно распространена в микробных матах и сыпучем материале , где биологически доступные уровни азота низки из-за высокой плотности микробов и анаэробной среды, которые обеспечивают функцию нитрогеназы , азотфиксирующего фермента. [24] Также были обнаружены доказательства ассимиляции , нитрификации , денитрификации , анаммокса , минерализации и диссимиляционного восстановления нитратов до аммония . [25] Например, сероокисляющие бактерии, такие как виды Begiatoa , выполняют денитрификацию и восстанавливают нитраты для окисления H 2 S. [24] Ассимиляция нитратов осуществляется симбиотическими видами трубчатого червя Riftia pachyptila . [24]
Наиболее распространенными бактериями гидротермальных источников являются хемолитотрофы. Эти бактерии используют восстановленные химические соединения, чаще всего серу, в качестве источников энергии для восстановления углекислого газа до органического углерода. [11] Численность хемолитотрофов в среде гидротермальных жерл определяется доступными источниками энергии; В жерлах с разной температурой концентрация питательных веществ разная, что предполагает большие различия между жерлами. В целом, большие микробные популяции обнаруживаются в шлейфах теплых жерловых вод (25 °C), на поверхностях, подвергающихся воздействию теплых жерловых шлейфов, а также в симбиотических тканях некоторых жерловых беспозвоночных вблизи жерловых жерл. [11]
Эти бактерии используют различные формы доступной серы (S - 2 , S0 , S2O3-2 ) в присутствии кислорода. Они составляют преобладающую популяцию в большинстве гидротермальных источников, поскольку их источник энергии широко доступен, а скорость хемосинтеза увеличивается в аэробных условиях. Бактерии гидротермальных источников аналогичны типам серобактерий, обитающих в других средах, богатых сероводородом, за исключением того, что на смену Thiobacillus пришла Thiomicrospira. Другими распространенными видами являются Thiothrix и Beggiatoa, которые имеют особое значение из-за своей способности фиксировать азот. [11]
Метан является существенным источником энергии в некоторых гидротермальных источниках, но не в других: в теплых источниках (25 ° C) метана больше, чем водорода. [11] Существует множество типов метанотрофных бактерий, которые нуждаются в кислороде и фиксируют CH 4 , CH 3 NH 2 и другие соединения C 1 , включая CO 2 и CO, если они присутствуют в сточной воде. [11] Этот тип бактерий также обнаружен в трофосоме Riftia , что указывает на симбиотические отношения. [11] Здесь метанокисляющие бактерии относятся к метанотрофам , которые не являются тем же самым, что и метаногены : Methanococcus и Methanocaldococcus jannaschii являются примерами метаногенов, [11] которые встречаются в гидротермальных источниках; тогда как Mmethylocystaceae являются метанотрофами, которые также были обнаружены в сообществах гидротермальных жерл. [26]
О микробах, использующих водород в качестве источника энергии, известно немного, однако исследования показали, что они аэробны, а также симбиотичны с рифтией (см. ниже). [11] [27] Эти бактерии играют важную роль в первичном производстве органического углерода, поскольку в этом процессе используется полученный геотермальным путем H 2 . [11] Водородокисляющие и денитрифицирующие бактерии могут обитать в жерлах, где NO 3 -содержащая придонная морская вода смешивается с гидротермальной жидкостью. [11] Desulfonauticus submarinus является гидрогенотрофом , который восстанавливает соединения серы в теплых источниках и был обнаружен у трубочных червей R. pachyptila и Alvinella pompejana. [28]
Эти бактерии обычно встречаются в отложениях железа и марганца на поверхностях, периодически подвергающихся воздействию шлейфов гидротермальной и придонной морской воды. Однако из-за быстрого окисления Fe 2+ в нейтральных и щелочных водах (т.е. в пресной и морской воде) бактерии, ответственные за окислительное отложение железа, чаще встречаются в кислых водах. [11] Бактерии, окисляющие марганец, будут более распространены в пресной и морской воде по сравнению с бактериями, окисляющими железо, из-за более высокой концентрации доступного металла. [11]
Симбиотический хемосинтез - важный процесс для гидротермальных жерловых сообществ. [11] В теплых жерлах обычными симбионтами бактерий являются глубоководные моллюски Calpytogena magnifica , мидии, такие как Bathyomodiolus thermophilus , и трубчатые черви-погонофоры, Riftia pachyptila и Alvinella pompejana . [11] [27] [ собственный источник? ] [28] Трофосомы этих животных являются особыми органами для симбионтов, содержащими ценные молекулы для хемосинтеза . Эти организмы стали настолько зависимы от своих симбионтов, что утратили все морфологические особенности, связанные с пищеварением и пищеварением, хотя бактерии обеспечиваются H 2 S и свободным O 2 . [11] Кроме того, из C. Magnifica и R. pachyptila были выделены метанокисляющие бактерии , что указывает на то, что ассимиляция метана может происходить внутри трофосомы этих организмов. [9]
Чтобы проиллюстрировать невероятное разнообразие гидротермальных источников, приведенный ниже список представляет собой совокупное представление типов и родов бактерий в алфавитном порядке. Как показано, протеобактерии, по-видимому, являются наиболее доминирующим типом, присутствующим в глубоководных жерлах.
Микробные сообщества, населяющие глубоководные гидротермальные жерла, по-видимому, сильно обогащены генами, которые кодируют ферменты, используемые в репарации несоответствий ДНК и гомологичной рекомбинации . [29] Это открытие предполагает, что эти микробные сообщества развили обширные возможности восстановления ДНК , чтобы справиться с экстремальными условиями, повреждающими ДНК , в которых они существуют. [29]

Вирусы — самая распространенная форма жизни в океане, таящая в себе величайший резервуар генетического разнообразия. [30] Поскольку их инфекции часто заканчиваются смертельным исходом, они представляют собой значительный источник смертности и, таким образом, оказывают широкое влияние на биологические океанографические процессы, эволюцию и биогеохимический цикл в океане. [31] Однако были обнаружены доказательства того, что вирусы, обнаруженные в жерловых средах обитания, приняли более мутуалистическую , чем паразитическую эволюционную стратегию, чтобы выжить в экстремальной и нестабильной среде, в которой они существуют. [32]
Было обнаружено, что глубоководные гидротермальные источники содержат большое количество вирусов, что указывает на высокую продукцию вирусов. [33] Образцы из гидротермальных источников Индевор у юго-западного побережья Британской Колумбии показали, что у активных чернокожих курильщиков содержание вируса составляло от 1,45×10 5 до 9,90×10 7 на мл, с падением численности, обнаруженным в гидротермальных источниках. вентиляционный шлейф (3,5×10 6 на мл) и вне системы вентиляции (2,94×10 6 на мл). Высокая плотность вирусов и, следовательно, их продукции (по сравнению с окружающими глубоководными водами) означает, что вирусы являются значительным источником микробной смертности в жерловых источниках. [33] Как и в других морских средах, глубоководные гидротермальные вирусы влияют на численность и разнообразие прокариот и, следовательно, влияют на микробный биогеохимический цикл, лизис своих хозяев для репликации. [34]
Однако, в отличие от своей роли источника смертности и контроля над популяцией, предполагается, что вирусы также повышают выживаемость прокариот в экстремальных условиях, выступая в качестве резервуаров генетической информации. Поэтому считается, что взаимодействие виросферы с микроорганизмами в условиях стресса окружающей среды способствует выживанию микроорганизмов за счет распространения генов хозяина посредством горизонтального переноса генов . [35]
Каждую секунду «в океане происходит примерно такое же количество инфекций, как у Авогадро , и каждое из этих взаимодействий может привести к передаче генетической информации между вирусом и хозяином». - Кертис Саттл [36]
Умеренные фаги (не вызывающие немедленного лизиса) иногда могут придавать фенотипы , которые улучшают приспособленность прокариот [7]. Лизогенный жизненный цикл может стабильно сохраняться в течение тысяч поколений инфицированных бактерий, а вирусы могут изменять фенотип хозяина, активируя гены ( процесс известное как лизогенная конверсия ), что позволяет хозяевам справляться с различными средами. [37] Польза для популяции-хозяина также может быть получена за счет экспрессии фенотипов, кодируемых фагами и улучшающих приспособленность. [38]

Обзор вирусных исследований в гидротермальных жерлах, опубликованный в 2015 году, показал, что жерла содержат значительную часть лизогенных хозяев и что большая часть вирусов являются умеренными, что указывает на то, что жерла могут дать преимущество профагу. [39]
Одно исследование взаимодействий вирус-хозяин в среде гидротермальных жерл с диффузным потоком показало, что высокая заболеваемость лизогенными хозяевами и большие популяции вирусов умеренного пояса уникальны по своим масштабам и что эти вирусы, вероятно, имеют решающее значение для системной экологии прокариот. Генетический анализ того же исследования показал, что 51% последовательностей вирусного метагенома были неизвестны (отсутствовали гомологии с данными секвенирования), с высоким разнообразием в жерловых средах, но с меньшим разнообразием для конкретных жерловых участков, что указывает на высокую специфичность для вирусных мишеней. [38]
Метагеномный анализ виромов глубоководных гидротермальных источников показал, что вирусные гены манипулируют метаболизмом бактерий , участвуя в метаболических путях, а также образуя разветвленные пути микробного метаболизма, которые облегчают адаптацию к экстремальным условиям окружающей среды. [40]
Пример этого был связан с бактерией SUP05, потребляющей серу. Исследование показало, что 15 из 18 вирусных геномов, секвенированных из образцов жерловых шлейфов, содержали гены, тесно связанные с ферментом, который хемолитоавтотрофы SUP05 используют для извлечения энергии из соединений серы. Авторы пришли к выводу, что такие фаговые гены ( вспомогательные метаболические гены ), которые способны усиливать метаболизм окисления серы в своих хозяевах, могут обеспечивать вирусам селективные преимущества (продолжающееся заражение и репликация). [41] Сходство вирусных генов и генов SUP05, отвечающих за метаболизм серы, предполагает обмен генами в прошлом и может указывать на то, что вирусы являются агентами эволюции. [42]
Другое метагеномное исследование показало, что вирусные гены имеют относительно высокую долю генов метаболизма, витаминов и кофакторов , что указывает на то, что вирусные геномы кодируют вспомогательные метаболические гены. В сочетании с наблюдениями за высокой долей лизогенных вирусов это указывает на то, что вирусы отбираются в качестве интегрированных провирусов, а не свободно плавающих вирусов, и что вспомогательные гены могут экспрессироваться, принося пользу как хозяину, так и интегрированному вирусу. Вирусы улучшают физическую форму, ускоряя метаболизм или предлагая большую метаболическую гибкость своим хозяевам. Имеющиеся данные свидетельствуют о том, что вирусные эволюционные стратегии глубоководных гидротермальных жерл способствуют длительной интеграции хозяина, отдавая предпочтение форме мутуализма, а не классическому паразитизму. [32]
Поскольку гидротермальные жерла являются выходами [ необходимы пояснения ] для материала подводного дна, также, вероятно, существует связь между жерловыми вирусами и вирусами в земной коре. [39]