В органической химии циклоприсоединение — это химическая реакция , в которой «две или более ненасыщенных молекулы (или части одной и той же молекулы) объединяются с образованием циклического аддукта , в котором происходит чистое уменьшение кратности связи ». Результирующая реакция является реакцией циклизации . Многие, но не все циклоприсоединения являются согласованными и, таким образом, перициклическими . [ 1] Несогласованные циклоприсоединения не являются перициклическими. [2] Как класс реакций присоединения , циклоприсоединения допускают образование углерод-углеродной связи без использования нуклеофила или электрофила .
Циклоприсоединения можно описать с помощью двух систем обозначений. Более старая, но все еще распространенная система обозначений основана на размере линейных расположений атомов в реагентах. Она использует скобки : ( i + j + …) , где переменные — это количество линейных атомов в каждом реагенте. Продукт — это цикл размером ( i + j + …) . В этой системе стандартная реакция Дильса-Альдера — это (4 + 2)-циклоприсоединение, 1,3-диполярное циклоприсоединение — это (3 + 2)-циклоприсоединение, а циклопропанирование карбена с алкеном — это (2 + 1)-циклоприсоединение. [1]
Более поздняя, предпочитаемая ИЮПАК нотация, впервые введенная Вудвордом и Хоффманном , использует квадратные скобки для указания числа электронов , а не атомов углерода, участвующих в образовании продукта. В нотации [ i + j + ...] стандартная реакция Дильса-Альдера представляет собой [4 + 2]-циклоприсоединение, в то время как 1,3-диполярное циклоприсоединение также является [4 + 2]-циклоприсоединением. [1]
Термические циклоприсоединения — это те циклоприсоединения, в которых реагенты находятся в основном электронном состоянии. Обычно в исходном материале участвуют (4 n + 2) π-электронов для некоторого целого числа n . Эти реакции происходят по причинам орбитальной симметрии в супрафациально -супрафациальном ( син / син стереохимия) в большинстве случаев. Также было описано очень мало примеров антарафациально -антарафациальных ( анти / анти стереохимия) реакций. Есть несколько примеров термических циклоприсоединений, в которых есть 4 n π-электронов (например, [2 + 2]-циклоприсоединение). Они протекают в супрафациально-антарафациальном смысле ( син / анти стереохимия), например, реакции циклоприсоединения производных кетена и аллена , в которых ортогональный набор p-орбиталей позволяет реакции протекать через перекрестное переходное состояние , хотя анализ этих реакций как [ π 2 s + π 2 a ] является спорным. Сообщалось также, что напряженные алкены, такие как производные транс -циклогептена, реагируют антарафациальным образом в реакциях [2 + 2]-циклоприсоединения.
Деринг (в личном сообщении Вудворду ) обнаружил, что гептафульвален и тетрацианоэтилен могут реагировать в супрафациально-антарафациальном [14 + 2]-циклоприсоединении. Этот результат был позже подтвержден и расширен Эрденом и Кауфманном, которые сообщили о супрафациально-антарафациальном циклоприсоединении гептафульвалена с N -фенилтриазолиндионом. [3]

Циклоприсоединения, в которых участвуют 4n π электронов, также могут происходить посредством фотохимической активации. Здесь один компонент имеет электрон, переведенный из HOMO (π-связывание) в LUMO (π* -антисвязывание ). Орбитальная симметрия тогда такова, что реакция может протекать супрафациальным-супрафциальным образом. Примером является реакция ДеМайо . Другой пример показан ниже — фотохимическая димеризация коричной кислоты . [4] Два транс- алкена реагируют голова к хвосту, и изолированные изомеры называются труксилловыми кислотами .
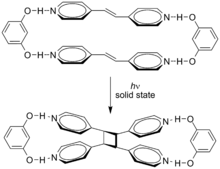
Супрамолекулярные эффекты могут влиять на эти циклоприсоединения. Циклоприсоединение транс -1,2-бис(4-пиридил)этена направляется резорцином в твердом состоянии с выходом 100% . [5]
Некоторые циклоприсоединения вместо π-связей осуществляются через напряженные циклопропановые кольца, поскольку они имеют значительный π-характер. Например, аналогом реакции Дильса-Альдера является реакция квадрициклан - DMAD :
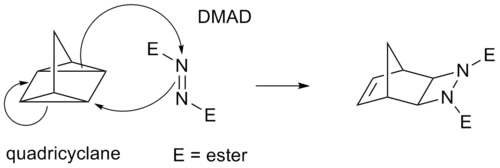
В записи циклоприсоединения (i+j+...) i и j относятся к числу атомов, участвующих в циклоприсоединении. В этой записи реакция Дильса-Альдера является (4+2)циклоприсоединением, а 1,3-диполярное присоединение, такое как первый шаг в озонолизе, является (3+2)циклоприсоединением. Однако предпочтительная запись ИЮПАК с [i+j+...] учитывает электроны, а не атомы. В этой записи реакция DA и диполярная реакция обе становятся [4+2]циклоприсоединением. Реакция между норборнадиеном и активированным алкином является [2+2+2]циклоприсоединением.
Реакция Дильса -Альдера, возможно, является наиболее важной и общеупотребительной реакцией циклоприсоединения. Формально это реакция циклоприсоединения [4+2] и существует в огромном диапазоне форм, включая реакцию Дильса-Альдера с обратным электронным спросом , реакцию Дильса-Альдера с гексадегидро и связанную с ней тримеризацию алкинов . Реакцию можно также запустить в обратном направлении в ретрореакции Дильса-Альдера .
Известны реакции с участием гетероатомов, в том числе аза-реакция Дильса–Альдера и иминная реакция Дильса–Альдера .
Реакция циклоприсоединения Хейсгена представляет собой (2+3)циклоприсоединение.
Циклоприсоединение нитрона к олефину представляет собой (3+2)циклоприсоединение.
Хелетропные реакции являются подклассом циклоприсоединений. Ключевой отличительной чертой хелетропных реакций является то, что на одном из реагентов обе новые связи образуются с одним и тем же атомом. Классическим примером является реакция диоксида серы с диеном .
Существуют и другие реакции циклоприсоединения: [4+3] циклоприсоединения , [6+4] циклоприсоединения , [2 + 2] фотоциклоприсоединения , металл-центрированное циклоприсоединение и [4+4] фотоциклоприсоединения.
Циклоприсоединения часто имеют катализируемые металлом и ступенчатые радикальные аналоги, однако, строго говоря, это не перициклические реакции. Когда в циклоприсоединении участвуют заряженные или радикальные промежуточные продукты или когда результат циклоприсоединения получается в серии стадий реакции, их иногда называют формальными циклоприсоединениями , чтобы провести различие с истинными перициклическими циклоприсоединениями.
Одним из примеров формального [3+3]циклоприсоединения между циклическим еноном и енамином , катализируемого н -бутиллитием, является каскадная реакция Сторка енамин / 1,2-присоединения : [6]
![Межмолекулярное формальное [3+3] циклоприсоединение между циклическим хлоридом иминия и циклопентеноном.](http://upload.wikimedia.org/wikipedia/commons/thumb/5/53/3%2B3_cycloaddition_-_cyclic_iminium_to_cyclic_enone.svg/500px-3%2B3_cycloaddition_-_cyclic_iminium_to_cyclic_enone.svg.png)
Катализаторы на основе дииминопиридина железа содержат окислительно-восстановительный активный лиганд, в котором центральный атом железа может координироваться с двумя простыми, нефункционализированными двойными связями олефина. Катализатор можно записать как резонанс между структурой, содержащей неспаренные электроны с центральным атомом железа в степени окисления II, и структурой, в которой железо находится в степени окисления 0. Это дает ему гибкость для связывания двойных связей, когда они подвергаются реакции циклизации, генерируя циклобутановую структуру посредством восстановительного элиминирования CC; в качестве альтернативы циклобутеновая структура может быть получена посредством элиминирования бета-водорода. Эффективность реакции существенно варьируется в зависимости от используемых алкенов, но рациональный дизайн лиганда может позволить расширить диапазон реакций, которые могут быть катализированы. [7] [8]