
В отличие от потенциала действия в клетках скелетных мышц , сердечный потенциал действия не инициируется нервной активностью. Вместо этого он возникает из группы специализированных клеток, известных как клетки водителя ритма , которые обладают способностью к автоматической генерации потенциала действия. В здоровом сердце эти клетки образуют водитель ритма сердца и находятся в синоатриальном узле в правом предсердии . Они производят примерно 60–100 потенциалов действия каждую минуту. Потенциал действия проходит вдоль клеточной мембраны, заставляя клетку сокращаться, поэтому активность синоатриального узла приводит к сердечному ритму в состоянии покоя примерно 60–100 ударов в минуту. Все клетки сердечной мышцы электрически связаны друг с другом с помощью вставных дисков , которые позволяют потенциалу действия передаваться от одной клетки к другой. [1] [2] Это означает, что все клетки предсердий могут сокращаться вместе, а затем все клетки желудочков.

Зависимость потенциала действия от скорости является фундаментальным свойством сердечных клеток, и изменения могут привести к тяжелым сердечным заболеваниям, включая сердечную аритмию , а иногда и к внезапной смерти. [3] Активность потенциала действия в сердце может быть зарегистрирована для получения электрокардиограммы (ЭКГ). Это серия восходящих и нисходящих пиков (обозначенных как P, Q, R, S и T), которые представляют собой деполяризацию (напряжение становится более положительным) и реполяризацию (напряжение становится более отрицательным) потенциала действия в предсердиях и желудочках . [ 4]
Подобно скелетным мышцам, мембранный потенциал покоя (напряжение, когда клетка не возбуждена электричеством) желудочковых клеток составляет около −90 милливольт (мВ; 1 мВ = 0,001 В), то есть внутренняя часть мембраны более отрицательна, чем внешняя. Основные ионы, находящиеся вне клетки в состоянии покоя, — это натрий (Na + ) и хлорид (Cl − ), тогда как внутри клетки это в основном калий (K + ). [6]
Потенциал действия начинается с того, что напряжение становится более положительным; это известно как деполяризация и в основном связано с открытием натриевых каналов , которые позволяют Na + поступать в клетку. После задержки (известной как абсолютный рефрактерный период ) потенциал действия заканчивается, когда открываются калиевые каналы, позволяя K + покинуть клетку и заставляя мембранный потенциал вернуться к отрицательному значению, это известно как реполяризация . Другим важным ионом является кальций (Ca 2+ ) , который можно найти внутри клетки в саркоплазматическом ретикулуме (SR), где хранится кальций, а также он находится вне клетки. Высвобождение Ca 2+ из SR посредством процесса, называемого кальций-индуцированным высвобождением кальция , жизненно важно для фазы плато потенциала действия (см. фазу 2 ниже) и является фундаментальным шагом в сопряжении возбуждения и сокращения сердца . [7]
Существуют важные физиологические различия между клетками-пейсмекерами синоатриального узла , которые спонтанно генерируют потенциал сердечного действия, и теми клетками, которые не являются пейсмекерами и которые просто его проводят, например, желудочковыми миоцитами . Конкретные различия в типах выраженных ионных каналов и механизмах их активации приводят к различиям в конфигурации формы волны потенциала действия, как показано на рисунке 2.
Сердечная автоматия, также известная как ауторитмичность , является свойством специализированных проводящих мышечных клеток сердца генерировать спонтанные потенциалы сердечного действия. [8] [9] Автоматия может быть нормальной или аномальной, вызванной временными изменениями характеристик ионных каналов , такими как использование определенных лекарств, или в случае аномальной автоматии изменения происходят в электротонической среде , вызванные, например, инфарктом миокарда . [10]

Стандартная модель, используемая для понимания потенциала действия сердца, — это модель желудочкового миоцита. Ниже приведены пять фаз потенциала действия желудочкового миоцита, также со ссылкой на потенциал действия SAN.

В желудочковом миоците фаза 4 происходит, когда клетка находится в состоянии покоя, в период, известный как диастола . В стандартной клетке без водителя ритма напряжение во время этой фазы более или менее постоянно, примерно на уровне -90 мВ. [11] Потенциал покоящейся мембраны является результатом потока ионов, поступивших в клетку (например, натрия и кальция), потока ионов, вышедших из клетки (например, калия, хлорида и бикарбоната), а также потока ионов, генерируемых различными мембранными насосами, которые идеально сбалансированы.
Активность этих насосов служит двум целям. Первая — поддерживать существование покоящегося мембранного потенциала путем противодействия деполяризации из-за утечки ионов, не находящихся в электрохимическом равновесии (например, натрия и кальция). Эти ионы, не находящиеся в равновесии, являются причиной существования электрического градиента, поскольку они представляют собой чистое смещение зарядов через мембрану, которые не могут немедленно вернуться в клетку, чтобы восстановить электрическое равновесие. Поэтому их медленное возвращение в клетку необходимо уравновесить, иначе клетка будет медленно терять свой мембранный потенциал.
Вторая цель, неразрывно связанная с первой, заключается в поддержании внутриклеточной концентрации более или менее постоянной и, в данном случае, в восстановлении исходных химических градиентов, то есть в принудительном выводе из клетки натрия и кальция, которые ранее поступали в клетку, и обратном выводе из нее калия, который ранее вытекал из клетки (хотя, поскольку калий в основном находится в состоянии электрохимического равновесия, его химический градиент естественным образом уравновесится в направлении, противоположном электрическому градиенту, без необходимости в активном транспортном механизме).
Например, ионы натрия (Na + ) и калия (K + ) поддерживаются натрий-калиевым насосом , который использует энергию (в форме аденозинтрифосфата (АТФ) ) для перемещения трех Na + из клетки и двух K + в клетку. Другим примером является натрий-кальциевый обменник , который удаляет один Ca 2+ из клетки за три Na + в клетку. [12]
В этой фазе мембрана наиболее проницаема для K + , который может перемещаться в клетку или из нее через каналы утечки, включая внутренний выпрямляющий калиевый канал. [13] Таким образом, потенциал покоящейся мембраны в основном равен равновесному потенциалу K + и может быть рассчитан с использованием уравнения напряжения Голдмана-Ходжкина-Каца .
Однако клетки-пейсмейкеры никогда не находятся в состоянии покоя. В этих клетках фаза 4 также известна как потенциал пейсмейкера . Во время этой фазы мембранный потенциал медленно становится более положительным, пока не достигнет заданного значения (около -40 мВ; известно как пороговый потенциал) или пока он не будет деполяризован другим потенциалом действия, исходящим от соседней клетки.
Считается, что потенциал водителя ритма обусловлен группой каналов, называемых каналами HCN (гиперполяризационно-активируемые циклические нуклеотид-управляемые) . Эти каналы открываются при очень отрицательных напряжениях (т. е. сразу после фазы 3 предыдущего потенциала действия; см. ниже) и позволяют проходить как K +, так и Na + в клетку. Из-за их необычного свойства активироваться очень отрицательными мембранными потенциалами, движение ионов через каналы HCN называется забавным током (см. ниже). [14]
Другая гипотеза относительно потенциала водителя ритма — «кальциевые часы». Кальций высвобождается из саркоплазматического ретикулума внутри клетки. Затем этот кальций увеличивает активацию натрий-кальциевого обменника , что приводит к увеличению мембранного потенциала (поскольку заряд +3 вносится в клетку (3Na + ), но только заряд +2 покидает клетку (Ca 2+ ), поэтому в клетку поступает чистый заряд +1). Затем этот кальций закачивается обратно в клетку и обратно в SR через кальциевые насосы (включая SERCA ). [15]
Эта фаза состоит из быстрого положительного изменения напряжения на клеточной мембране ( деполяризация ), длящегося менее 2 мс в желудочковых клетках и 10–20 мс в клетках SAN . [16] Это происходит из-за чистого потока положительного заряда в клетку.
В клетках, не являющихся водителями ритма (т. е. желудочковых клетках), это происходит преимущественно за счет активации Na + -каналов , что увеличивает проводимость (поток) мембраны Na + (gNa ) . Эти каналы активируются, когда потенциал действия поступает из соседней клетки через щелевые контакты . Когда это происходит, напряжение внутри клетки немного увеличивается. Если это повышенное напряжение достигает порогового потенциала (приблизительно −70 мВ), оно заставляет Na + -каналы открываться. Это вызывает больший приток натрия в клетку, быстро увеличивая напряжение еще больше примерно до +50 мВ, [6], т. е. в направлении равновесного потенциала Na + . Однако, если начальный стимул недостаточно силен и пороговый потенциал не достигнут, быстрые натриевые каналы не будут активированы и потенциал действия не будет произведен; это известно как закон «все или ничего» . [17] [18] Приток ионов кальция (Ca 2+ ) через кальциевые каналы L-типа также составляет незначительную часть эффекта деполяризации. [19] Наклон фазы 0 на форме волны потенциала действия (см. рисунок 2) представляет максимальную скорость изменения напряжения сердечного потенциала действия и известен как dV/dt max .
Однако в клетках водителя ритма (например, клетках синоатриального узла ) увеличение мембранного напряжения происходит в основном из-за активации кальциевых каналов L-типа. Эти каналы также активируются увеличением напряжения, однако на этот раз это происходит либо из-за потенциала водителя ритма (фаза 4), либо из-за надвигающегося потенциала действия. Кальциевые каналы L-типа активируются медленнее, чем натриевые каналы, поэтому наклон деполяризации в волне потенциала действия водителя ритма менее крутой, чем в волне потенциала действия не водителя ритма. [11] [20]
Эта фаза начинается с быстрой инактивации Na + -каналов внутренними воротами (воротами инактивации), что снижает движение натрия в клетку. В то же время калиевые каналы (называемые I to1 ) быстро открываются и закрываются, позволяя кратковременному потоку ионов калия из клетки, делая мембранный потенциал немного более отрицательным. Это называется «выемкой» на форме волны потенциала действия. [11]
В клетках водителя ритма явной фазы 1 не наблюдается.
Эта фаза также известна как фаза «плато» из-за того, что мембранный потенциал остается почти постоянным, так как мембрана медленно начинает реполяризоваться. Это происходит из-за почти полного баланса заряда, движущегося в клетку и из нее. Во время этой фазы калиевые каналы замедленного выпрямления (I ks ) позволяют калию покидать клетку, в то время как кальциевые каналы L-типа (активируемые притоком натрия во время фазы 0) позволяют ионам кальция перемещаться в клетку. Эти ионы кальция связываются и открывают больше кальциевых каналов (называемых рианодиновыми рецепторами), расположенных на саркоплазматическом ретикулуме внутри клетки, позволяя кальцию выходить из СР. Эти ионы кальция отвечают за сокращение сердца.
Кальций также активирует хлоридные каналы, называемые I to2 , которые позволяют Cl − проникать в клетку. Повышенная концентрация кальция в клетке также увеличивает активность натрий-кальциевых обменников, в то время как повышенная концентрация натрия (из-за деполяризации фазы 0) увеличивает активность натрий-калиевых насосов. Движение всех этих ионов приводит к тому, что мембранный потенциал остается относительно постоянным, при этом отток K + , приток Cl − , а также насосы Na + /K + способствуют реполяризации, а приток Ca 2+ , а также обменники Na + /Ca 2+ способствуют деполяризации. [21] [11] Эта фаза отвечает за большую продолжительность потенциала действия и важна для предотвращения нерегулярного сердцебиения (сердечной аритмии).
В потенциалах действия пейсмекера отсутствует фаза плато.
Во время фазы 3 (фазы «быстрой реполяризации») потенциала действия каналы L-типа Ca 2+ закрываются, в то время как медленные каналы замедленного выпрямления (I Ks ) K + остаются открытыми, поскольку открывается больше каналов утечки калия. Это обеспечивает чистый выходящий положительный ток, соответствующий отрицательному изменению мембранного потенциала , тем самым позволяя открыться большему количеству типов каналов K + . Это в первую очередь каналы быстрого замедленного выпрямления K + (I Kr ) и внутренний выпрямляющий ток K + , I K1 . Этот чистый выходящий положительный ток (равный потере положительного заряда клетки) заставляет клетку реполяризоваться. Каналы замедленного выпрямления K + закрываются, когда мембранный потенциал восстанавливается примерно до -85–90 мВ, в то время как I K1 остается проводящим в течение фазы 4, что помогает установить мембранный потенциал покоя [22]
Ионные насосы, как обсуждалось выше, такие как натрий-кальциевый обменник и натрий-калиевый насос, восстанавливают концентрацию ионов до сбалансированных состояний до потенциала действия. Это означает, что внутриклеточный кальций выкачивается, что отвечало за сокращение сердечных миоцитов. Как только он теряется, сокращение прекращается, и сердечные мышцы расслабляются.
В синоатриальном узле эта фаза также обусловлена закрытием кальциевых каналов L-типа, что предотвращает внутренний поток Ca 2+ и открытием быстрых замедленных выпрямительных калиевых каналов (I Kr ). [23]
У сердечных клеток есть два рефрактерных периода , первый — от начала фазы 0 до половины фазы 3; это известно как абсолютный рефрактерный период, в течение которого клетка не может произвести другой потенциал действия. За этим немедленно следует, до конца фазы 3, относительный рефрактерный период, в течение которого требуется более сильный, чем обычно, стимул для производства другого потенциала действия. [24] [25]
Эти два рефрактерных периода вызваны изменениями в состояниях натриевых и калиевых каналов . Быстрая деполяризация клетки во время фазы 0 приводит к тому, что мембранный потенциал приближается к равновесному потенциалу натрия (т. е. мембранному потенциалу, при котором натрий больше не втягивается в клетку или из нее). Когда мембранный потенциал становится более положительным, натриевые каналы закрываются и блокируются, это известно как «инактивированное» состояние. Во время этого состояния каналы не могут быть открыты независимо от силы возбуждающего стимула — это приводит к абсолютному рефрактерному периоду. Относительный рефрактерный период обусловлен утечкой ионов калия, что делает мембранный потенциал более отрицательным (т. е. он гиперполяризован), это сбрасывает натриевые каналы; открывая ворота инактивации, но все еще оставляя канал закрытым. Поскольку некоторые из потенциалзависимых натриевых ионных каналов восстановились, а потенциалзависимые калиевые ионные каналы остаются открытыми, можно инициировать другой потенциал действия, если стимул сильнее стимула, который может запустить потенциал действия, когда мембрана находится в состоянии покоя. [26]
Щелевые контакты позволяют потенциалу действия передаваться от одной клетки к другой (они, как говорят, электрически соединяют соседние сердечные клетки ). Они сделаны из семейства белков коннексинов , которые образуют поры, через которые могут проходить ионы (включая Na + , Ca 2+ и K + ). Поскольку в клетке больше всего калия, в основном проходит калий. Это повышенное содержание калия в соседней клетке заставляет мембранный потенциал немного увеличиваться, активируя натриевые каналы и инициируя потенциал действия в этой клетке. (Кратковременный химический градиент, управляемый оттоком Na + через коннексон при пиковой деполяризации, вызывает деполяризацию от клетки к клетке, а не калия.) [27] Эти соединения обеспечивают быструю проводимость потенциала действия по всему сердцу и отвечают за то, чтобы все клетки в предсердиях сокращались вместе, а также все клетки в желудочках. [28] Нескоординированное сокращение сердечных мышц является основой аритмии и сердечной недостаточности. [29]
Ионные каналы — это белки, которые изменяют форму в ответ на различные стимулы, чтобы либо разрешить, либо предотвратить перемещение определенных ионов через мембрану. Говорят, что они избирательно проницаемы. Стимулы, которые могут поступать как извне клетки, так и изнутри клетки, могут включать связывание определенной молекулы с рецептором на канале (также известные как лиганд-зависимые ионные каналы ) или изменение мембранного потенциала вокруг канала, обнаруживаемое датчиком (также известные как потенциал-зависимые ионные каналы ), и могут открывать или закрывать канал. Пора, образованная ионным каналом, является водной (заполненной водой) и позволяет иону быстро перемещаться через мембрану. [33] Ионные каналы могут быть селективными для определенных ионов, поэтому существуют специфические каналы Na + , K + , Ca 2+ и Cl − . Они также могут быть специфическими для определенного заряда ионов (т. е. положительного или отрицательного). [34]
Каждый канал кодируется набором инструкций ДНК, которые сообщают клетке, как его создать. Эти инструкции известны как ген . На рисунке 3 показаны важные ионные каналы, участвующие в сердечном потенциале действия, ток (ионы), который протекает через каналы, их основные белковые субъединицы (строительные блоки канала), некоторые из их контролирующих генов, которые кодируют их структуру, и фазы, которые активны во время сердечного потенциала действия. Некоторые из наиболее важных ионных каналов, участвующих в сердечном потенциале действия, кратко описаны ниже.
Активируемые гиперполяризацией циклические нуклеотид-зависимые каналы (каналы HCN) расположены в основном в клетках водителя ритма, эти каналы становятся активными при очень отрицательных мембранных потенциалах и позволяют проходить как Na +, так и K + в клетку (что является движением, известным как забавный ток, I f ). Эти плохо селективные катионные (положительно заряженные ионы) каналы проводят больше тока, когда мембранный потенциал становится более отрицательным (гиперполяризованным). Активность этих каналов в клетках SAN заставляет мембранный потенциал медленно деполяризоваться, и поэтому они, как полагают, отвечают за потенциал водителя ритма. Симпатические нервы напрямую влияют на эти каналы, что приводит к увеличению частоты сердечных сокращений (см. ниже). [35] [14]
Эти натриевые каналы зависят от напряжения, быстро открываются из-за деполяризации мембраны, которая обычно происходит из соседних клеток, через щелевые контакты. Они обеспечивают быстрый поток натрия в клетку, полностью деполяризуя мембрану и инициируя потенциал действия. По мере увеличения мембранного потенциала эти каналы затем закрываются и блокируются (становятся неактивными). Из-за быстрого притока ионов натрия (крутая фаза 0 в форме волны потенциала действия) активация и инактивация этих каналов происходят почти в одно и то же время. Во время состояния инактивации Na + не может пройти (абсолютный рефрактерный период). Однако они начинают восстанавливаться после инактивации, когда мембранный потенциал становится более отрицательным (относительный рефрактерный период).
Два основных типа калиевых каналов в сердечных клетках — это внутренние выпрямители и потенциалзависимые калиевые каналы. [ необходима цитата ]
Внутренне выпрямляющие калиевые каналы (K ir) способствуют потоку K + в клетку. Однако этот приток калия больше, когда мембранный потенциал более отрицателен, чем равновесный потенциал для K + (~-90 мВ). По мере того, как мембранный потенциал становится более положительным (т. е. во время стимуляции клетки соседней клеткой), поток калия в клетку через K ir уменьшается. Поэтому K ir отвечает за поддержание покоящегося мембранного потенциала и инициирование фазы деполяризации. Однако, по мере того, как мембранный потенциал продолжает становиться более положительным, канал начинает пропускать K + из клетки. Этот внешний поток ионов калия при более положительных мембранных потенциалах означает, что K ir также может способствовать конечным стадиям реполяризации. [36] [37]
Потенциалзависимые калиевые каналы (K v ) активируются деполяризацией. Токи, создаваемые этими каналами, включают транзитный калиевый ток I to1 . Этот ток состоит из двух компонентов. Оба компонента активируются быстро, но I to,fast инактивируется быстрее, чем I to, slow . Эти токи способствуют ранней фазе реполяризации (фазе 1) потенциала действия. [ необходима цитата ]
Другой формой потенциалзависимых калиевых каналов являются калиевые каналы с задержкой выпрямления. Эти каналы переносят калиевые токи, которые отвечают за фазу плато потенциала действия, и названы в зависимости от скорости, с которой они активируются: медленно активирующие I Ks , быстро активирующие I Kr и сверхбыстро активирующие I Kur . [38]
В сердечной мышце есть два потенциалзависимых кальциевых канала : кальциевые каналы L-типа («L» означает Длительные) и кальциевые каналы T-типа («T» означает Переходные, т. е. Короткие). Каналы L-типа более распространены и наиболее плотно заселены в мембране T-трубочек желудочковых клеток, тогда как каналы T-типа встречаются в основном в клетках предсердий и кардиостимуляторов , но все же в меньшей степени, чем каналы L-типа. [ необходима цитата ]
Эти каналы реагируют на изменения напряжения на мембране по-разному: каналы L-типа активируются более положительными мембранными потенциалами, открываются дольше и остаются открытыми дольше, чем каналы T-типа. Это означает, что каналы T-типа вносят больший вклад в деполяризацию (фаза 0), тогда как каналы L-типа вносят больший вклад в плато (фаза 2). [39]

В системе проводимости сердца электрическая активность, которая исходит из синоатриального узла (SAN), распространяется через сеть Гиса - Пуркинье , самый быстрый путь проводимости в сердце. Электрический сигнал проходит от синоатриального узла, который стимулирует сокращение предсердий , к атриовентрикулярному узлу (AVN) , который замедляет проведение потенциала действия от предсердий к желудочкам . Эта задержка позволяет желудочкам полностью наполниться кровью перед сокращением. Затем сигнал проходит вниз через пучок волокон, называемый пучком Гиса , расположенный между желудочками, а затем к волокнам Пуркинье в нижней части (верхушке) сердца, вызывая сокращение желудочков. [ необходима цитата ]
В дополнение к SAN, AVN и волокна Пуркинье также обладают пейсмекерной активностью и поэтому могут спонтанно генерировать потенциал действия. Однако эти клетки обычно не деполяризуются спонтанно, просто потому, что производство потенциала действия в SAN происходит быстрее. Это означает, что до того, как AVN или волокна Пуркинье достигнут порогового потенциала для потенциала действия, они деполяризуются встречным импульсом от SAN [40] Это называется «подавлением перегрузки». [41] Пейсмекерная активность этих клеток жизненно важна, поскольку это означает, что если SAN выйдет из строя, то сердце может продолжать биться, хотя и с более низкой частотой (AVN = 40-60 ударов в минуту, волокна Пуркинье = 20-40 ударов в минуту). Эти кардиостимуляторы будут поддерживать жизнь пациента до прибытия бригады неотложной помощи. [ требуется цитата ]
Примером преждевременного сокращения желудочков является классический синдром спортивного сердца . Постоянные тренировки спортсменов вызывают сердечную адаптацию, при которой частота SAN в состоянии покоя ниже (иногда около 40 ударов в минуту). Это может привести к атриовентрикулярной блокаде , когда сигнал от SAN нарушается на своем пути к желудочкам. Это приводит к нескоординированным сокращениям между предсердиями и желудочками без правильной задержки между ними и в тяжелых случаях может привести к внезапной смерти. [42]
Скорость возникновения потенциала действия в клетках водителя ритма зависит от вегетативной нервной системы , но не контролируется ею .
Симпатическая нервная система (нервы, доминирующие во время реакции организма «бей или беги» ) увеличивает частоту сердечных сокращений (положительная хронотропия ), уменьшая время для создания потенциала действия в SAN. Нервы из спинного мозга выделяют молекулу, называемую норадреналином , которая связывается и активирует рецепторы на мембране клетки водителя ритма, называемые β1-адренорецепторами . Это активирует белок, называемый G s -белком (s для стимулирующего). Активация этого G-белка приводит к повышению уровня цАМФ в клетке (через путь цАМФ ). цАМФ связывается с каналами HCN (см. выше), увеличивая ток Fin и, следовательно, увеличивая скорость деполяризации во время потенциала водителя ритма. Увеличение цАМФ также увеличивает время открытия кальциевых каналов L -типа, увеличивая ток Ca 2+ через канал, ускоряя фазу 0. [43]
Парасимпатическая нервная система ( нервы, доминирующие, когда организм отдыхает и переваривает пищу) снижает частоту сердечных сокращений (отрицательная хронотропия ), увеличивая время, необходимое для создания потенциала действия в SAN. Нерв, называемый блуждающим нервом , который начинается в мозге и перемещается в синоатриальный узел, высвобождает молекулу, называемую ацетилхолином (ACh) , которая связывается с рецептором, расположенным снаружи клетки водителя ритма, называемым мускариновым рецептором M2 . Это активирует белок G i (I для ингибиторного), который состоит из 3 субъединиц (α, β и γ), которые при активации отделяются от рецептора. Субъединицы β и γ активируют специальный набор калиевых каналов, увеличивая отток калия из клетки и уменьшая мембранный потенциал, что означает, что клеткам водителя ритма требуется больше времени, чтобы достичь своего порогового значения. [44] Белок G i также ингибирует путь цАМФ, тем самым уменьшая симпатические эффекты, вызываемые спинномозговыми нервами. [45]
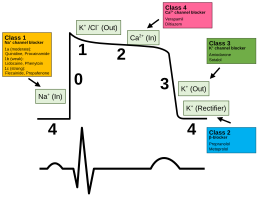
Антиаритмические препараты используются для регулирования слишком быстрого сердечного ритма . Другие препараты, используемые для влияния на потенциал действия сердца, включают блокаторы натриевых каналов , бета-блокаторы , блокаторы калиевых каналов и блокаторы кальциевых каналов .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )