Органическое соединение 1,1,1-трихлорэтан , также известное как метилхлороформ и хлоротен , представляет собой хлоралкан с химической формулой CH3CCl3 . Это изомер 1,1,2-трихлорэтана . Бесцветная и сладко пахнущая жидкость, когда-то производилась промышленным способом в больших количествах для использования в качестве растворителя . [ 5] Он регулируется Монреальским протоколом как озоноразрушающее вещество, и его использование в качестве такового сократилось с 1996 года. Трихлорэтан не следует путать с похожим по звучанию трихлорэтеном , который также широко используется в качестве растворителя.
1,1,1-Трихлорэтан был впервые описан Анри Виктором Реньо в 1840 году. В промышленности его обычно производят в два этапа из винилхлорида . На первом этапе винилхлорид реагирует с хлористым водородом при температуре 20-50 °C с образованием 1,1-дихлорэтана :
Эта реакция катализируется различными кислотами Льюиса , в основном хлоридом алюминия , хлоридом железа (III) или хлоридом цинка . Затем 1,1-дихлорэтан превращается в 1,1,1-трихлорэтан путем реакции с хлором под ультрафиолетовым облучением:
Эта реакция протекает с выходом 80-90%, а побочный продукт хлористый водород может быть возвращен на первую стадию процесса. Основным побочным продуктом является родственное соединение 1,1,2-трихлорэтан , из которого 1,1,1-трихлорэтан может быть отделен путем перегонки .
Несколько меньшее количество 1,1,1-трихлорэтана образуется в результате реакции 1,1-дихлорэтена и хлористого водорода в присутствии катализатора хлорида железа (III) :
1,1,1-Трихлорэтан продается со стабилизаторами, поскольку он нестабилен по отношению к дегидрохлорированию и воздействует на некоторые металлы. Стабилизаторы составляют до 8% формулы, включая поглотители кислот (эпоксиды, амины) и комплексообразователи .
1,1,1-Трихлорэтан является прекрасным растворителем для многих органических соединений , а также одним из наименее токсичных хлорированных углеводородов . Обычно его считают неполярным , но благодаря хорошей поляризуемости атомов хлора он является превосходным растворителем для органических соединений, которые плохо растворяются в углеводородах, таких как гексан . До Монреальского протокола он широко использовался для очистки металлических деталей и печатных плат , как растворитель фоторезиста в электронной промышленности, как пропеллент аэрозолей , как добавка к смазочно-охлаждающей жидкости и как растворитель для чернил, красок, клеев и других покрытий. 1,1,1-Трихлорэтан использовался для сухой чистки кожи и замши . [6] 1,1,1-Трихлорэтан также используется в качестве инсектицидного фумиганта .
Он также был стандартным очистителем для фотопленки (фильмы/слайды/негативы и т. д.). Другие общедоступные растворители повреждают эмульсию и основу ( ацетон серьезно повреждает триацетатную основу на большинстве пленок), и поэтому не подходят для этого применения. Стандартная замена, Форан 141, гораздо менее эффективна и имеет тенденцию оставлять осадок. 1,1,1-Трихлорэтан использовался в качестве разбавителя в корректирующих жидкостях, таких как жидкая бумага . Во многих из его применений ранее использовался четыреххлористый углерод (который был запрещен в потребительских товарах США в 1970 году). В свою очередь, сам 1,1,1-трихлорэтан теперь заменяется другими растворителями в лаборатории. [7]
1,1,1-Трихлорэтан был одним из летучих хлорорганических соединений, которые были опробованы в качестве альтернативы хлороформу при анестезии. [8] В 1880-х годах было обнаружено, что он является безопасной и сильной заменой хлороформу [9], но его производство было дорогим и сложным. [10]
В 1880 году 1,1,1-трихлорэтан был предложен в качестве анестетика. В том же году его впервые назвали «метилхлороформом». В то время наркотические эффекты хлоралгидрата объяснялись гипотетическим метаболическим путем к хлороформу в «щелочной крови». Трихлорэтан изучался на предмет его структурного сходства с хлоралем и потенциальных анестезирующих эффектов. Однако трихлорэтан не демонстрировал никакого преобразования в хлороформ в лабораторных экспериментах. Изомер 1,1,2-трихлорэтана , в котором отсутствовала трихлорметильная группа , демонстрировал анестезирующие эффекты даже сильнее, чем изомер 1,1,1. [11]
Хотя 1,1,1-трихлорэтан не так токсичен , как многие подобные соединения, вдыхаемый или проглатываемый 1,1,1-трихлорэтан действует как депрессант центральной нервной системы и может вызывать эффекты, схожие с эффектами интоксикации этанолом , включая головокружение , спутанность сознания и, при достаточно высоких концентрациях, потерю сознания и смерть. [12] Сообщалось о смертельных отравлениях и заболеваниях, связанных с преднамеренным вдыханием трихлорэтана. [13] [14] [15] [16] Удаление этого химического вещества из корректирующей жидкости началось в связи с Предложением 65, объявляющим его опасным и токсичным. [17] [18]
Длительный контакт кожи с жидкостью может привести к удалению жиров с кожи , что вызовет раздражение кожи.
Международное агентство по изучению рака относит 1,1,1-трихлорэтан к группе 2А как вероятный канцероген . [19]
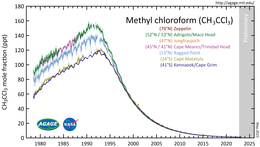

1,1,1-Трихлорэтан является довольно мощным парниковым газом со 100-летним потенциалом глобального потепления 169 относительно углекислого газа . [20] Тем не менее, это меньше одной десятой от четыреххлористого углерода , который он заменил в качестве растворителя, из-за его относительно короткого времени жизни в атмосфере , около 5 лет. [21]
Монреальский протокол определил 1,1,1-трихлорэтан как соединение, ответственное за истощение озонового слоя , и запретил его использование с 1996 года. С тех пор его производство и использование были прекращены в большинстве стран мира, а его концентрация в атмосфере существенно снизилась. [21]
описываем четыре случая внезапной смерти подростков, связанных с любительским вдыханием жидкости для исправления ошибок на пишущей машинке, произошедшие в период с 1979 по середину 1984 г.
13-летний мальчик был найден мертвым в лесу после вдыхания 1,1,1-трихлорэтана (TCE).
Gillette согласилась переформулировать продукт так, чтобы он не представлял риска, требующего предупреждения о Предложении 65