Химическое соединение
18-метоксикоронаридин ( 18-MC или MM-110 ), также известный как золуникант , является производным ибогаина , изобретенным в 1996 году исследовательской группой под руководством фармаколога Стэнли Д. Глика из Медицинского колледжа Олбани и химиков Упула К. Бандаража и Мартина Э. Кюне из Университета Вермонта . В исследованиях на животных он доказал свою эффективность в снижении самостоятельного приема морфина , кокаина , метамфетамина , никотина и сахарозы . [1] [2] Также было показано, что он вызывает аноректический эффект у тучных крыс, скорее всего, из-за тех же действий на систему вознаграждения, которые лежат в основе его антиаддиктивного эффекта против наркотической зависимости. [3]
18-MC находился на ранних стадиях испытаний на людях калифорнийской компанией по разработке лекарств Savant HWP, прежде чем был приобретен MindMed, канадской фармацевтической компанией, недавно вышедшей на биржу NASDAQ в апреле 2021 года. [4] [5] В 2002 году исследовательская группа начала собирать средства для испытаний на людях, но не смогла обеспечить предполагаемые необходимые 5 миллионов долларов. [6] В 2010 году Obiter Research, производитель химикатов в Шампейне, штат Иллинойс , подписал патентную лицензию с Медицинским колледжем Олбани и Университетом Вермонта , предоставив им право синтезировать и продавать 18-MC и другие конгенеры. В 2012 году Национальный институт по борьбе со злоупотреблением наркотиками выделил Savant HWP грант в размере 6,5 миллионов долларов для испытаний на людях. [5] В 2017 году он перешел на фазу II испытаний в Бразилии для лечения лейшманиоза в Институте Эвандро Шагаса , [7] но не для одобрения для использования в качестве лечения наркотической зависимости. Исследование фазы 2a лечения ММ-110 у пациентов, страдающих от отмены опиоидов , должно начаться во втором квартале 2022 года. [8]
Фармакология
18-MC является антагонистом никотина α3β4 и , в отличие от ибогаина, не имеет сродства к подтипу α4β2 , ни к NMDA-каналам , ни к переносчику серотонина [9] и имеет значительно сниженное сродство к натриевым каналам и к σ-рецептору , но сохраняет скромное сродство к μ-опиоидным рецепторам , где он действует как агонист [10] и κ-опиоидным рецепторам [11] . Места действия в мозге включают медиальную поводковую часть , межножковое ядро [12] [ 13] [14] дорсолатеральную покрышку и базолатеральную миндалевидную железу . [15] (±)-18-MC конкурентно ингибирует α9α10 nAChR с эффективностью, превышающей таковую у α3β4 и α4β2 nAChR, и напрямую блокирует Ca V 2.2 . [16]
Химия
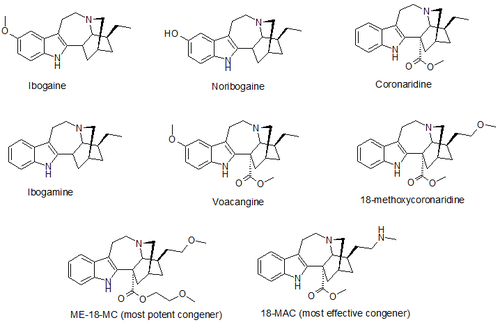
Производные
Было разработано несколько производных 18-MC, некоторые из которых превосходят сам 18-MC, метоксиэтиловый конгенер ME-18-MC более эффективен, чем 18-MC, с аналогичной эффективностью, а метиламиноаналог 18-MAC более эффективен, чем 18-MC, с примерно такой же эффективностью. Было также обнаружено, что эти соединения действуют как селективные α 3 β 4 никотиновые ацетилхолиновые антагонисты , с небольшим или нулевым эффектом на рецепторы NMDA. [17] [18]
Смотрите также
Ссылки
- ^ Glick SD, Kuehne ME, Maisonneuve IM, Bandarage UK, Molinari HH (май 1996 г.). «18-Метоксикоронаридин, нетоксичный конгенер алкалоида ибоги: влияние на самостоятельный прием морфина и кокаина и на мезолимбическое высвобождение дофамина у крыс». Brain Research . 719 (1–2): 29–35. doi :10.1016/0006-8993(96)00056-X. PMID 8782860. S2CID 6178161.
- ^ Glick SD, Sell EM, Maisonneuve IM (декабрь 2008 г.). «Области мозга, опосредующие эффекты альфа3бета4 никотинового антагониста 18-MC при самостоятельном приеме метамфетамина и сахарозы». European Journal of Pharmacology . 599 (1–3): 91–5. doi :10.1016/j.ejphar.2008.09.038. PMC 2600595 . PMID 18930043.
- ^ Таращенко OD, Рубиначчио HY, Мэзоннёв IM, Глик SD (декабрь 2008 г.). «18-метоксикоронаридин: потенциальное новое лечение ожирения у крыс?». Психофармакология . 201 (3): 339–50. doi :10.1007/s00213-008-1290-9. PMC 3787601. PMID 18751969 .
- ^ Mindmed приобретает препарат для лечения опиоидной зависимости на основе природного психоделика ибогаина newswire.ca 16 сентября 2019 г.
- ^ Ученый из Albany Med приблизился к успеху в борьбе с наркотической зависимостью timesunion.com 27 июня 2014 г.
- ^ Лечение наркомании стремится к легитимности. Журнал Американской медицинской ассоциации . 2002; 288: 3096-3101.
- ^ «Фаза 2 испытания по оценке эффективности, безопасности и переносимости 18-метоксикоронаридина у пациентов с кожным лейшманиозом». ClinicalTrials.gov . Получено 19 февраля 2020 г. .
- ^ «Расстройство, вызванное употреблением опиоидов: потенциал золуниканта для неудовлетворенных потребностей в лечении». MindMed.co. 20 мая 2022 г. Получено 23 мая 2022 г.
- ^ Maisonneuve IM, Glick SD (июнь 2003 г.). «Противоаддиктивное действие алкалоида ибоги: новый механизм для нового лечения». Фармакология, биохимия и поведение . 75 (3): 607–18. doi :10.1016/S0091-3057(03)00119-9. PMID 12895678. S2CID 26758480.
- ^ Антонио Т., Чайлдерс СР., Ротман РБ., Дерш СМ., Кинг С., Кюне М. и др. (2013). «Влияние алкалоидов ибоги на активацию G-белка, связанного с μ-опиоидным рецептором». PLOS ONE . 8 (10): e77262. Bibcode : 2013PLoSO...877262A. doi : 10.1371/journal.pone.0077262 . PMC 3818563. PMID 24204784 .
- ^ Glick SD, Maisonneuve IM, Hough LB, Kuehne ME, Bandarage UK. (±)-18-метоксикоронаридин: новый конгенер алкалоида ибоги, обладающий потенциальной эффективностью против зависимости. CNS Drug Reviews 1999;5(1):27-42.
- ^ Glick SD, Ramirez RL, Livi JM, Maisonneuve IM (май 2006 г.). «18-Метоксикоронаридин действует в медиальном хребте и/или межножковом ядре, снижая самостоятельное введение морфина у крыс». European Journal of Pharmacology . 537 (1–3): 94–8. doi :10.1016/j.ejphar.2006.03.045. PMID 16626688.
- ^ Таращенко OD, Шулан JM, Maisonneuve IM, Glick SD (июль 2007). "18-MC действует в медиальном habenula и межножковом ядре, ослабляя сенсибилизацию дофамина к морфину в прилежащем ядре". Synapse . 61 (7): 547–60. doi :10.1002/syn.20396. PMID 17447255. S2CID 2252348.
- ^ Таращенко OD, Руббиначчио HY, Шулан JM, Глик SD, Мэйсоннёв IM (июль 2007). «Изменения высвобождения ацетилхолина в межножковом ядре, вызванные морфином, и связь с изменениями в двигательном поведении у крыс». Нейрофармакология . 53 (1): 18–26. doi :10.1016/j.neuropharm.2007.04.010. PMC 2025684 . PMID 17544456.
- ^ Glick SD, Sell EM, Maisonneuve IM (декабрь 2008 г.). «Области мозга, опосредующие эффекты альфа3бета4 никотинового антагониста 18-MC при самостоятельном приеме метамфетамина и сахарозы». European Journal of Pharmacology . 599 (1–3): 91–5. doi :10.1016/j.ejphar.2008.09.038. PMC 2600595 . PMID 18930043.
- ^ Arias HR, Tae HS, Micheli L, Yousuf A, Ghelardini C, Adams DJ, Di Cesare Mannelli L (сентябрь 2020 г.). «Конгенеры коронаридина уменьшают нейропатическую боль у мышей и ингибируют никотиновые ацетилхолиновые рецепторы α9α10 и каналы CaV2.2». Neuropharmacology . 175 : 108194. doi :10.1016/j.neuropharm.2020.108194. hdl : 2158/1213504 . PMID 32540451. S2CID 219705597.
- ^ Kuehne ME, He L, Jokiel PA, Pace CJ, Fleck MW, Maisonneuve IM и др. (июнь 2003 г.). «Синтез и биологическая оценка конгенеров 18-метоксикоронаридина. Потенциальные антиаддиктивные агенты». Журнал медицинской химии . 46 (13): 2716–30. doi :10.1021/jm020562o. PMID 12801235.
- ^ Pace CJ, Glick SD, Maisonneuve IM, He LW, Jokiel PA, Kuehne ME, Fleck MW (май 2004 г.). «Новые конгенеры ибога-алкалоидов блокируют никотиновые рецепторы и снижают самостоятельное назначение лекарств». European Journal of Pharmacology . 492 (2–3): 159–67. doi :10.1016/j.ejphar.2004.03.062. PMID 15178360.