В металлоорганической химии агостическое взаимодействие относится к внутримолекулярному взаимодействию координационно-ненасыщенного переходного металла с соответствующим образом расположенной связью C−H на одном из его лигандов. Взаимодействие является результатом двух электронов, вовлеченных во взаимодействие связи C−H с пустой d-орбиталью переходного металла, что приводит к трехцентровой двухэлектронной связи . [1] Это особый случай комплекса C–H sigma . Исторически агостические комплексы были первыми примерами комплексов C–H sigma , которые наблюдались спектроскопически и кристаллографически, поскольку внутримолекулярные взаимодействия были особенно благоприятны и чаще приводили к прочным комплексам. Предполагается, что многие каталитические превращения, включающие окислительное присоединение и восстановительное элиминирование , протекают через промежуточные продукты, характеризующиеся агостическими взаимодействиями. Агостические взаимодействия наблюдаются во всей металлоорганической химии в алкильных , алкилиденовых и полиенильных лигандах.
Термин агостик, происходящий от древнегреческого слова, означающего «держать близко к себе», был придуман Морисом Брукхартом и Малкольмом Грином по предложению классика Джаспера Гриффина для описания этого и многих других взаимодействий между переходным металлом и связью C−H . Часто такие агостикские взаимодействия включают алкильные или арильные группы, которые удерживаются близко к металлическому центру посредством дополнительной σ-связи. [2] [3]
Короткие взаимодействия между углеводородными заместителями и координационно ненасыщенными комплексами металлов были отмечены с 1960-х годов. Например, в трис( трифенилфосфин ) рутений дихлориде короткое взаимодействие наблюдается между центром рутения (II) и атомом водорода в орто-положении одного из девяти фенильных колец. [4] Комплексы борогидрида описываются как использующие модель трехцентровой двухэлектронной связи .
Природа взаимодействия была предсказана в химии основной группы в структурной химии триметилалюминия .
Агостические взаимодействия лучше всего демонстрируются кристаллографией . Данные нейтронной дифракции показали, что расстояния связей C−H и M┄H на 5–20 % больше, чем ожидалось для изолированного гидрида металла и углеводородов. Расстояние между металлом и водородом обычно составляет 1,8–2,3 Å , а угол M┄H−C находится в диапазоне 90°–140°. Наличие сигнала ЯМР 1 H , который смещен в сторону сильного поля от сигнала нормального арила или алкана, часто в область, обычно приписываемую гидридным лигандам. Константа связи 1 J CH обычно снижается до 70–100 Гц по сравнению со 125 Гц, ожидаемыми для нормальной связи углерод–водород sp 3 .

На основе экспериментальных и вычислительных исследований стабилизация, возникающая в результате агостического взаимодействия, оценивается в 10–15 ккал/моль. Недавние расчеты с использованием констант податливости указывают на более слабую стабилизацию (<10 ккал/моль). [6] Таким образом, агостические взаимодействия сильнее большинства водородных связей . Агостические связи иногда играют роль в катализе, увеличивая «жесткость» в переходных состояниях. Например, в катализе Циглера-Натта высокоэлектрофильный металлический центр имеет агостические взаимодействия с растущей полимерной цепью. Эта повышенная жесткость влияет на стереоселективность процесса полимеризации.

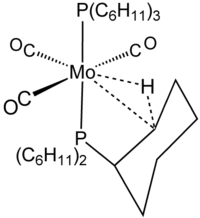
Термин агостик зарезервирован для описания двухэлектронных, трехцентровых связывающих взаимодействий между углеродом, водородом и металлом. Двухэлектронная трехцентровая связь явно участвует в комплексообразовании H 2 , например, в W(CO) 3 (PCy 3 ) 2 H 2 , который тесно связан с агостическим комплексом, показанным на рисунке. [8] Силан часто связывается с металлическими центрами посредством агостикоподобных, трехцентровых взаимодействий Si┄H−M. Однако, поскольку эти взаимодействия не включают углерод, они не классифицируются как агостик.
Некоторые взаимодействия M┄H−C не классифицируются как агостические, а описываются термином анагостические . Анагостические взаимодействия имеют более электростатический характер. С точки зрения структур анагостических взаимодействий расстояния M┄H и углы M┄H−C попадают в диапазоны 2,3–2,9 Å и 110°–170° соответственно. [2] [9]
Агостические взаимодействия играют ключевую роль в полимеризации алкенов и стереохимии , а также в миграционной вставке .