Птичий грипп , также известный как птичий грипп , — это заболевание, вызываемое вирусом гриппа А , которое в первую очередь поражает птиц, но иногда может поражать млекопитающих, включая людей. [1] Дикие водоплавающие птицы являются основными хозяевами вируса гриппа А, который является энзоотическим (постоянно присутствующим) во многих популяциях птиц. [2] [3]
Симптомы птичьего гриппа различаются в зависимости как от штамма вируса, лежащего в основе инфекции, так и от вида пораженной птицы или млекопитающего. Классификация штамма вируса как низкопатогенного птичьего гриппа (LPAI) или высокопатогенного птичьего гриппа (HPAI) основана на тяжести симптомов у домашних кур и не предсказывает тяжесть симптомов у других видов. [4] Куры, инфицированные LPAI, проявляют легкие симптомы или бессимптомны , тогда как HPAI вызывает серьезные затруднения дыхания, значительное снижение яйценоскости и внезапную смерть. [5] Домашняя птица может быть потенциально защищена от определенных штаммов вируса путем вакцинации. [6]
Люди и другие млекопитающие могут заразиться птичьим гриппом только после длительного тесного контакта с инфицированными птицами. [7] У млекопитающих, включая людей, заражение птичьим гриппом (будь то LPAI или HPAI) встречается редко. Симптомы инфекции варьируются от легких до тяжелых, включая лихорадку, диарею и кашель. [8]
Вирус гриппа А выделяется со слюной, слизью и фекалиями инфицированных птиц; другие инфицированные животные могут выделять вирусы птичьего гриппа с респираторными выделениями и другими жидкостями организма (например, коровьим молоком). [9] Вирус может быстро распространяться среди домашних птиц и среди диких птиц. [9] Особенно вирулентный штамм, вирус гриппа А подтипа H5N1 (A/H5N1), может уничтожить поголовье домашней птицы, и, по оценкам, в попытках сдержать вирус было убито около полумиллиарда птиц, выращиваемых на фермах. [10]
Из-за влияния птичьего гриппа на экономически важные птицеводческие фермы в 1981 году была разработана система классификации, которая разделила штаммы птичьего вируса на высокопатогенные (и, следовательно, потенциально требующие решительных мер контроля) и низкопатогенные. Тест на это основан исключительно на воздействии на кур - штамм вируса является высокопатогенным птичьим гриппом (ВППГ), если 75% или более кур погибают после преднамеренного заражения им. Альтернативная классификация - низкопатогенный птичий грипп (НППГ). [11] С тех пор эта система классификации была изменена, чтобы принять во внимание структуру белка гемагглютинина вируса. [12] Другие виды птиц, особенно водоплавающие, могут заразиться вирусом HPAI, не испытывая серьезных симптомов, и могут распространять инфекцию на большие расстояния; точные симптомы зависят от вида птицы и штамма вируса. [11] Классификация штамма птичьего вируса как HPAI или LPAI не позволяет предсказать, насколько серьезным может быть заболевание, если оно заразит людей или других млекопитающих. [11] [13]
С 2006 года Всемирная организация здравоохранения животных требует сообщать обо всех случаях обнаружения LPAI H5 и H7 из-за их потенциальной возможности мутировать в высокопатогенные штаммы. [14]

Птичий грипп вызывается вирусом гриппа А , который в основном поражает птиц, но может также инфицировать людей и других млекопитающих. [16] [17] Грипп А — это РНК-вирус с геномом, включающим отрицательно-полярный РНК-сегментированный геном, который кодирует 11 вирусных генов. [18] Вирусная частица (также называемая вирионом) имеет диаметр 80–120 нанометров и эллиптическую или нитевидную форму. [19] [20] Имеются данные о том, что вирус может выживать в течение длительного времени в пресной воде после выделения с фекалиями его птичьим хозяином и может выдерживать длительное замораживание. [21]
На поверхности вирусной оболочки находятся два белка : гемагглютинин и нейраминидаза. [4] Это основные антигены вируса, против которых вырабатываются нейтрализующие антитела. Эпидемии и эпизоотии вируса гриппа связаны с изменениями в его антигенной структуре. [22]
Гемагглютинин (H) — это антигенный гликопротеин , который позволяет вирусу связываться с клеткой-хозяином и проникать в нее. Нейраминидаза (N) — это антигенный гликозилированный фермент , который облегчает высвобождение потомства вирусов из инфицированных клеток. [23] Известно 18 типов гемагглютинина, из которых H1 — H16 были обнаружены у птиц, и 11 типов нейраминидазы. [16]
Подтипы гриппа A определяются комбинацией белков H и N в вирусной оболочке ; например, « H5N1 » обозначает подтип гриппа A, который имеет белок гемагглютинина (H) типа 5 и белок нейраминидазы (N) типа 1. [7] Схема подтипирования учитывает только два белка оболочки, а не другие белки, кодируемые РНК вируса. Почти все возможные комбинации H (от 1 до 16) и N (от 1 до 11) были выделены из диких птиц. [24] Дополнительные вариации существуют внутри подтипов и могут привести к очень значительным различиям в способности вируса инфицировать и вызывать заболевание. [25]

Для однозначного описания конкретного изолята вируса исследователи используют международно принятую номенклатуру вирусов гриппа [26] , которая описывает, среди прочего, вид животного, от которого был выделен вирус, а также место и год сбора. Например, A/chicken/Nakorn-Patom/Thailand/CU-K2/04(H5N1) :
Другие примеры включают: A/duck/Hong Kong/308/78(H5N3), A/avian/NY/01(H5N2), A/chicken/Mexico/31381-3/94(H5N2) и A/shoveler/Egypt/03(H5N2). [27]
Анализ генома вируса позволяет исследователям определить порядок его нуклеотидов. Сравнение генома вируса с геномом другого вируса может выявить различия между двумя вирусами. [16] [28] Генетические вариации важны, поскольку они могут изменять аминокислоты, из которых состоят белки вируса гриппа, что приводит к структурным изменениям белков и, таким образом, к изменению свойств вируса. Некоторые из этих свойств включают способность обходить иммунитет и способность вызывать тяжелое заболевание. [28]
Генетическое секвенирование позволяет дополнительно охарактеризовать штаммы гриппа по их кладам или субкладам , выявляя связи между различными образцами вируса и отслеживая эволюцию вируса с течением времени. [28]
В редких случаях люди могут заразиться птичьим гриппом, если они находятся в тесном контакте с инфицированными птицами. Симптомы варьируются от легких до тяжелых (включая смерть), но эти случаи не имели устойчивой передачи от одного человека к другому. [4] [17]
Существует ряд факторов, которые обычно не позволяют птичьему гриппу вызывать эпидемии среди людей или других млекопитающих. [29] [30] Одним из них является то, что белок HA птичьего гриппа связывается с рецепторами сиаловой кислоты альфа-2,3 , которые присутствуют в дыхательных путях и кишечнике птиц, в то время как HA человеческого гриппа связывается с рецепторами сиаловой кислоты альфа-2,6, которые присутствуют в верхних дыхательных путях человека. [31] [32] Другие факторы включают способность реплицировать геном вирусной РНК в ядре клетки-хозяина, избегать иммунных реакций хозяина и передаваться между особями. [33]
Вирусы гриппа постоянно изменяются по мере накопления небольших генетических мутаций , процесс, известный как антигенный дрейф . Со временем мутация может привести к изменению антигенных свойств, так что антитела хозяина (приобретенные в результате вакцинации или предшествующей инфекции) не будут обеспечивать эффективную защиту, что приведет к новой вспышке заболевания. [34]
Сегментированный геном вирусов гриппа облегчает генетическую реассортацию . Это может произойти, если хозяин одновременно инфицирован двумя разными штаммами вируса гриппа; тогда вирусы могут обмениваться генетическим материалом по мере размножения в клетках хозяина. [35] Таким образом, вирус птичьего гриппа может приобретать характеристики, такие как способность заражать людей, от другого штамма вируса. Наличие как альфа 2,3, так и альфа 2,6 рецепторов сиаловой кислоты в тканях свиньи допускает коинфекцию вирусами птичьего гриппа и человеческого гриппа. Эта восприимчивость делает свиней потенциальным «плавильным котлом» для реассортации вирусов гриппа А. [36]
Птичий грипп (исторически известный как птичья чума) вызывается адаптированными к птицам штаммами вируса гриппа типа А. [ 4] Заболевание было впервые выявлено Эдоардо Перрончито в 1878 году, когда он был дифференцирован от других заболеваний, вызывающих высокий уровень смертности среди птиц; в 1955 году было установлено, что вирус птичьей чумы тесно связан с человеческим гриппом. В 1972 году стало очевидно, что многие подтипы птичьего гриппа были эндемичными в популяциях диких птиц. [11]
В период с 1959 по 1995 год было зафиксировано 15 вспышек высокопатогенного птичьего гриппа (ВПГП) среди домашней птицы, при этом потери варьировались от нескольких птиц на одной ферме до многих миллионов. В период с 1996 по 2008 год вспышки ВПГП среди домашней птицы были зарегистрированы по меньшей мере 11 раз, и 4 из этих вспышек привели к гибели или выбраковке миллионов птиц. [11] С тех пор несколько штаммов вируса (как ВПГП, так и ВПГП) стали эндемичными среди диких птиц, а вспышки среди домашней птицы стали все более частыми, особенно подтипов H5 и H7.
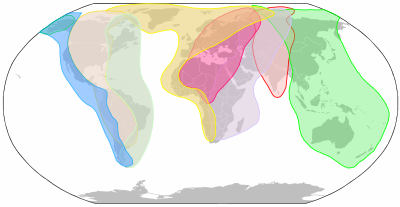
Птицы - Вирусы гриппа А различных подтипов имеют большой резервуар в диких водоплавающих птицах отрядов гусеобразных (например, утки, гуси и лебеди) и ржанкообразных (например, чайки, крачки и кулики), которые могут инфицировать дыхательные пути и желудочно-кишечный тракт, не влияя на здоровье хозяина. [38] Затем они могут переноситься птицей на большие расстояния, особенно во время ежегодной миграции. Инфицированные птицы могут выделять вирусы птичьего гриппа А в своей слюне, носовых выделениях и фекалиях; восприимчивые птицы заражаются при контакте с вирусом, который выделяют инфицированные птицы. [39] Вирус может выживать в течение длительного времени в воде и при низких температурах и может распространяться с одной фермы на другую на сельскохозяйственном оборудовании. [40] Домашние птицы (куры, индейки, утки и т. д.) могут заразиться вирусами птичьего гриппа А через прямой контакт с инфицированными водоплавающими птицами или другими инфицированными домашними птицами, а также через контакт с загрязненными фекалиями или поверхностями.
Вспышки птичьего гриппа у домашних птиц вызывают беспокойство по нескольким причинам. Существует вероятность того, что вирусы птичьего гриппа с низкой патогенностью (LPAI) могут эволюционировать в штаммы, которые являются высокопатогенными для домашней птицы (HPAI), и последующий потенциал для значительного заболевания и смерти среди домашней птицы во время вспышек. В связи с этим международные правила гласят, что любое обнаружение подтипов H5 или H7 (независимо от их патогенности) должно быть сообщено в соответствующий орган. [41] [42] Также возможно, что вирусы птичьего гриппа могут передаваться людям и другим животным, которые контактировали с инфицированными птицами, вызывая инфекцию с непредсказуемыми, но иногда и фатальными последствиями.
При обнаружении инфекции HPAI у домашней птицы обычно забивают инфицированных животных и находящихся поблизости животных в попытке быстро сдержать, контролировать и искоренить болезнь. Это делается вместе с ограничениями передвижения, улучшением гигиены и биологической безопасности, а также усилением наблюдения. [40]
Люди - Вирусы птичьего гриппа, как HPAI, так и LPAI, могут заражать людей, которые находятся в тесном, незащищенном контакте с инфицированной домашней птицей. Случаи межвидовой передачи редки, с симптомами, варьирующимися по степени тяжести от отсутствия симптомов или легкого заболевания до тяжелого заболевания, приведшего к смерти. [43] [42] По состоянию на февраль 2024 года было очень мало случаев передачи от человека к человеку, и каждая вспышка была ограничена несколькими людьми. [44] Все подтипы птичьего гриппа A имеют потенциал для преодоления видового барьера, при этом H5N1 и H7N9 считаются самыми большими угрозами. [45] [46]
Чтобы избежать заражения, широкой общественности рекомендуется избегать контакта с больными птицами или потенциально зараженными материалами, такими как туши или фекалии. Людям, работающим с птицами, например, экологам или работникам птицеводства, рекомендуется носить соответствующие средства индивидуальной защиты. [47]
Другие животные - птичий грипп поразил широкий спектр других животных , как правило, из-за употребления в пищу инфицированных птиц. [48] Были случаи, когда могла иметь место передача заболевания между млекопитающими, включая тюленей и коров. [49] [50]
Вирусы гриппа имеют относительно высокую скорость мутаций, что характерно для РНК-вирусов . [51] Сегментация генома вируса гриппа А облегчает генетическую рекомбинацию путем реассортации сегментов у хозяев, которые одновременно заражаются двумя разными штаммами вирусов гриппа. [52] [53] При реассортации между штаммами птичий штамм, который не поражает людей, может приобрести характеристики от другого штамма, которые позволяют ему заражать и передаваться от человека к человеку — зоонозное событие. [39] Считается, что все вирусы гриппа А, вызывающие вспышки или пандемии среди людей с 1900-х годов, произошли от штаммов, циркулирующих среди диких водоплавающих птиц, путем реассортации с другими штаммами гриппа. [54] [55] Возможно (хотя и не наверняка), что свиньи могут выступать в качестве промежуточного хозяина для реассортации. [56]
По состоянию на июнь 2024 года существует обеспокоенность по поводу двух подтипов птичьего гриппа, которые циркулируют в популяциях диких птиц по всему миру, H5N1 и H7N9 . Оба они потенциально могут уничтожить поголовье домашней птицы, и оба перешли на людей с относительно высокими показателями летальности . [57]
Глобальная система надзора за гриппом и реагирования на него (GISRS) — это глобальная сеть лабораторий, которые отслеживают распространение гриппа с целью предоставления Всемирной организации здравоохранения информации о контроле над гриппом и информирования о разработке вакцин. [58] Ежегодно сеть GISRS тестирует несколько миллионов образцов через сеть лабораторий в 127 странах. [59] Помимо человеческих вирусов, GISRS отслеживает птичьи, свиные и другие потенциально зоонозные вирусы гриппа.
Птица - можно вакцинировать птицу против определенных штаммов гриппа HPAI. Вакцинацию следует сочетать с другими мерами контроля, такими как мониторинг инфекции, раннее обнаружение и биобезопасность. [60] [61]
Люди - Доступно несколько "кандидатных вакцин" на случай, если птичий вирус приобретет способность инфицировать и передаваться среди людей. Существуют стратегические запасы вакцин против подтипа H5N1, который считается самым рискованным. [62] [63] [64] Вакцина против подтипа H7N9, который также инфицировал людей, прошла ограниченное количество испытаний. [65] В случае вспышки "кандидатная" вакцина будет быстро проверена на безопасность, а также эффективность против зоонозного штамма, а затем авторизована и распространена среди производителей вакцин. [66]
Вакцина против зоонозного гриппа Seqirus разрешена к применению в Европейском Союзе. [67] Это вакцина против H5N8, которая предназначена для обеспечения приобретенного иммунитета против вирусов гриппа А подтипа H5. [67]
Высокопатогенный вирус гриппа А подтипа H5N1 — это новый вирус птичьего гриппа, который вызывает глобальную обеспокоенность как потенциальная угроза пандемии . Его часто называют просто «птичьим гриппом» или «птичьим гриппом», хотя это всего лишь один из многих подтипов.
A/H5N1 убил миллионы домашних птиц во все большем числе стран Азии, Европы и Африки. Эксперты в области здравоохранения обеспокоены тем, что сосуществование вирусов гриппа человека и вирусов птичьего гриппа (особенно H5N1) предоставит возможность для обмена генетическим материалом между вирусами, специфичными для конкретных видов, что может привести к появлению нового вирулентного штамма гриппа, который легко передается и смертелен для людей. [68]
Грипп A/H5N1 был впервые зарегистрирован в небольшой вспышке среди домашней птицы в Шотландии [69] в 1959 году, с многочисленными вспышками впоследствии на каждом континенте. [70] Первая известная передача A/H5N1 человеку произошла в Гонконге в 1997 году, когда произошла вспышка из 18 случаев заболевания людей, приведшая к 6 смертельным исходам. Было установлено, что все инфицированные люди контактировали с инфицированными птицами на рынках домашней птицы. Поскольку болезнь продолжала распространяться среди домашних птиц на территории, было принято решение забить все 1,6 миллиона домашних птиц в этом районе и ввести строгий контроль за перемещением и обращением с домашней птицей. Это положило конец вспышке. [71] [72]
Имеются слабые доказательства в поддержку ограниченной передачи вируса A/H5N1 от человека к человеку в 139 вспышках между 2005 и 2009 годами на Суматре. Число репродукций было значительно ниже порогового значения для устойчивой передачи. [73]
В период с 2003 по октябрь 2024 года Всемирная организация здравоохранения зарегистрировала 921 подтвержденный случай гриппа H5N1, приведший к 464 смертельным случаям. [74] Истинный уровень смертности может быть ниже, поскольку некоторые случаи со слабовыраженными симптомами могли не быть идентифицированы как H5N1. [75]

Значительная вспышка вируса гриппа А подтипа H7N9 (A/H7N9) началась в марте 2013 года, когда тяжелый грипп поразил 18 человек в Китае; шесть впоследствии умерли. [76] Было обнаружено, что низкопатогенный штамм A/H7N9 циркулировал среди кур, и что все пострадавшие люди были подвержены воздействию на рынках птицы . Дальнейшие случаи среди людей и птицы в материковом Китае продолжали выявляться спорадически в течение года, за которыми последовал пик около праздничного сезона китайского Нового года (январь и февраль) в начале 2014 года, который был приписан сезонному всплеску производства птицы. До декабря 2013 года было зарегистрировано 139 случаев с 47 смертельными исходами. [77]
Инфекции среди людей и домашней птицы продолжались в течение следующих нескольких лет, снова с пиками около нового года. В 2016 году появился штамм вируса, который был высокопатогенным для кур. [78] [79] Чтобы сдержать вспышку HPAI, китайские власти в 2017 году инициировали крупномасштабную кампанию вакцинации против птичьего гриппа у домашней птицы. С тех пор количество вспышек среди домашней птицы, а также количество случаев заболевания людей значительно сократилось. У людей симптомы и смертность как от штаммов LPAI, так и HPAI были схожими. [78] Хотя с февраля 2019 года не было зарегистрировано ни одного случая заражения человека H7N9, вирус все еще циркулирует среди домашней птицы, особенно среди кур-несушек. Он продемонстрировал антигенный дрейф, чтобы уклоняться от вакцин, и остается потенциальной угрозой для птицеводческой отрасли и общественного здравоохранения. [79]
Генетический и эволюционный анализы показали, что вирусы A(H7) в китайской вспышке, вероятно, перешли от домашней утки к популяциям кур в Китае, а затем реассортировали с птичьим гриппом A(H9N2), чтобы создать штамм гриппа A(H7N9), который поразил людей. Генетические характеристики вируса A(H7N9) вызывают беспокойство из-за их пандемического потенциала, например, их способности распознавать рецепторы вируса человеческого и птичьего гриппа, что влияет на способность вызывать устойчивую передачу от человека к человеку или способность реплицироваться в организме человека. [76]
В период с февраля 2013 года по февраль 2019 года было подтверждено 1568 случаев заболевания людей и 616 смертей, связанных со вспышкой в Китае. [80] [81] Большинство случаев заболевания людей были связаны с контактом с домашней птицей на рынках или фермах. Передача между людьми остается ограниченной с некоторыми свидетельствами небольших семейных кластеров. Однако нет никаких доказательств устойчивой передачи гриппа A/H7N9 от человека к человеку. [78]
В начале 2017 года в США произошли вспышки птичьего гриппа A(H7N9) среди домашней птицы. Штамм в этих вспышках имел североамериканское происхождение и не связан с азиатской линией H7N9, которая связана с человеческими инфекциями в Китае. [78]
Несколько видов домашних животных были инфицированы вирусом H5N1 и продемонстрировали симптомы этой инфекции, включая кошек, собак, хорьков, свиней и птиц. [82]
В Соединенных Штатах предпринимаются попытки минимизировать присутствие HPAI у домашней птицы посредством рутинного наблюдения за стадами домашней птицы в коммерческих птицеводческих хозяйствах. Обнаружение вируса HPAI может привести к немедленной выбраковке стада. Менее патогенные вирусы контролируются вакцинацией. [83]
Птичий грипп был впервые обнаружен у молочных коров в нескольких штатах США в апреле 2024 года и впоследствии распространился более широко в течение года. Было обнаружено, что грипп A(H5N1) присутствует в высоких уровнях в молочных железах и в молоке пораженных коров. [87] [88] [89] Было показано, что вирус может сохраняться на доильном оборудовании, что обеспечивает вероятный путь передачи от коровы к корове и от коровы к человеку. [90] У ряда людей, которые контактировали с коровами, тесты на вирус дали положительный результат, со слабыми симптомами. [91]
В 2005 году было объявлено о создании Международного партнерства по птичьему и пандемическому гриппу с целью повышения значимости птичьего гриппа, координации усилий и улучшения отчетности и надзора за болезнями для лучшего реагирования на будущие пандемии. Появились новые сети лабораторий для обнаружения и реагирования на птичий грипп, такие как Центр управления кризисами в области здоровья животных, Глобальная сеть по надзору за птичьим гриппом, OFFLU и Глобальная система раннего предупреждения об основных болезнях животных. После вспышки 2003 года государства-члены ВОЗ также признали необходимость более прозрачного и справедливого обмена вакцинами и другими преимуществами этих сетей. [92] Совместные меры, принятые в ответ на HPAI, послужили основой для программ, связанных с другими возникающими и повторно возникающими инфекционными заболеваниями.
Контроль HPAI также использовался в политических целях. В Индонезии переговоры с глобальными сетями реагирования использовались для рецентрализации власти и финансирования в Министерстве здравоохранения. [93] Во Вьетнаме политики при поддержке Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО) использовали контроль HPAI для ускорения индустриализации производства животноводческой продукции на экспорт, предложив увеличить долю крупных коммерческих ферм и сократить количество птицеводов с 8 до 2 миллионов к 2010 году. [94]
Производство домашней птицы на заднем дворе рассматривалось как «традиционная азиатская» сельскохозяйственная практика, которая контрастировала с современным коммерческим производством домашней птицы и рассматривалась как угроза биологической безопасности. Производство домашней птицы на заднем дворе, по-видимому, несло в себе больший риск, чем коммерческое производство, из-за отсутствия биологической безопасности и тесного контакта с людьми, хотя распространение HPAI в интенсивно выращиваемых стадах было выше из-за высокой плотности выращивания и генетической однородности. [95] [96] Сама азиатская культура была обвинена как причина того, что определенные вмешательства, такие как те, которые рассматривали только вмешательства на основе размещения, потерпят неудачу без поиска многогранных решений. [94]
Примерно 20% потребляемого в развивающихся странах белка поступает из птицы. [95] В отчете ФАО подсчитано, что общие экономические потери, вызванные птичьим гриппом в Юго-Восточной Азии к 2005 году, составили около 10 миллиардов долларов США. Это оказало наибольшее влияние на мелких коммерческих и домашних производителей. [97]
Поскольку домашняя птица служит источником продовольственной безопасности и ликвидных активов, наиболее уязвимыми группами населения были бедные мелкие фермеры. [94] Потеря птиц из-за HPAI и выбраковки во Вьетнаме привела к средней потере 2,3 месяцев производства и 69–108 долларов США для домохозяйств, многие из которых имеют доход 2 доллара в день или меньше. [97] Потерю продовольственной безопасности для уязвимых домохозяйств можно увидеть в задержке роста детей в возрасте до пяти лет в Египте. Женщины являются еще одной группой риска, поскольку в большинстве регионов мира небольшие стада находятся под присмотром женщин. Широко распространенная выбраковка также привела к сокращению числа девочек, посещающих школы в Турции. [95]
Настоящий Меморандум был составлен подписавшими его лицами, указанными на странице 590, по случаю встречи, состоявшейся в Женеве в феврале 1980 года.
вируса гриппа связывается с альфа-2–3-связанными (вирусы птиц) или альфа-2–6-связанными (вирусы человека) сиаловыми кислотами, представленными белками или липидами на поверхности клетки-хозяина.
Если птичий вирус мутирует или перестраивается и приобретает способность связываться с α2,6-связанными сиаловыми кислотами, он может преодолеть видовой барьер и заразить людей. Ткани свиней экспрессируют обе формы сиаловой кислоты и могут быть коинфицированы человеческими и птичьими вирусами. Таким образом, свиньи служат плавильным сосудом для штаммов человеческого, птичьего и свиного гриппа.
{{cite journal}}: CS1 maint: overridden setting (link)Всемирная организация здравоохранения (ВОЗ)
Продовольственная и сельскохозяйственная организация ООН (ФАО)
Всемирная организация охраны здоровья животных (МЭБ)
Соединенные Штаты
Европа