Хлорметилирование Блана ( также называемое реакцией Блана ) представляет собой химическую реакцию ароматических колец с формальдегидом и хлористым водородом с образованием хлорметиларенов. Реакция катализируется кислотами Льюиса, такими как хлорид цинка . [1] Реакция была открыта Гюставом Луи Бланом (1872-1927) в 1923 году. [2] [3]
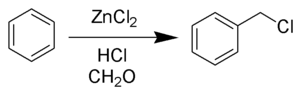
Реакцию проводят в кислых условиях и с использованием катализатора ZnCl 2 . В этих условиях карбонил формальдегида протонируется, что делает углерод гораздо более электрофильным. Затем альдегид подвергается атаке ароматических пи-электронов с последующей реароматизацией ароматического кольца. Образовавшийся таким образом бензиловый спирт в условиях реакции быстро превращается в хлорид.

Другие возможности для электрофила включают катион (хлорметил)оксония (ClH 2 C–OH 2 + ) или катион хлоркарбения (ClCH 2 + ), которые могут образовываться в присутствии хлорида цинка. [4] Эти виды могут объяснить тот факт, что умеренно и сильно дезактивированные субстраты, инертные к реакциям Фриделя-Крафтса, такие как ацетофенон, нитробензол и п- хлорнитробензол [5], действительно демонстрируют предельную реакционную способность и ограниченную синтетическую полезность в условиях хлорметилирования. [6] Дезактивированные субстраты дают лучшие результаты в модифицированных условиях хлорметилирования с использованием хлорметилметилового эфира (MOMCl) в присутствии 60% H 2 SO 4 . [4]
Высокоактивированные арены, такие как фенолы и анилины, не являются подходящими субстратами, поскольку они подвергаются дальнейшей электрофильной атаке за счет алкилирования по Фриделю-Крафтсу с образованием бензилового спирта/хлорида неконтролируемым образом. В общем, образование побочного продукта диарилметана является обычным результатом. [6]
Хотя реакция является эффективным способом введения хлорметильной группы, производство небольших количеств высококанцерогенного бис(хлорметилового) эфира является недостатком для промышленного применения.
Соответствующие реакции фторметилирования, бромметилирования и иодометилирования также можно осуществить с использованием соответствующей галоидоводородной кислоты. [7]
Хлорметилирование тиолов можно осуществлять концентрированной HCl и формальдегидом: [8]
Хлорметилирование также можно осуществить с использованием хлорметилметилового эфира:
Эта реакция используется при хлорметилировании стирола в производстве ионообменных смол и смол Меррифилда . [9]
Реакцию проводят с осторожностью, поскольку, как и большинство реакций хлорметилирования, в качестве побочного продукта образуется высококанцерогенный бис(хлорметил)эфир .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )