Эндосомальные сортировочные комплексы, необходимые для механизма транспорта ( ESCRT ), состоят из цитозольных белковых комплексов, известных как ESCRT-0, ESCRT-I, ESCRT-II и ESCRT-III. Вместе с рядом дополнительных белков эти комплексы ESCRT обеспечивают уникальный способ ремоделирования мембран , который приводит к изгибу/отпочкованию мембран от цитоплазмы . [1] [2] Эти компоненты ESCRT были выделены и изучены на ряде организмов, включая дрожжи и человека. [3] Эукариотический сигнатурный белок , механизм обнаружен у всех эукариот и некоторых архей . [4]
Аппарат ESCRT играет жизненно важную роль в ряде клеточных процессов, включая биогенез мультивезикулярных телец (MVB), клеточное отделение и почкование вируса . Биогенез мультивезикулярных телец (MVB) представляет собой процесс, при котором меченные убиквитином белки проникают в органеллы , называемые эндосомами , посредством образования везикул . Этот процесс необходим клеткам для разрушения неправильно свернутых и поврежденных белков. [5] Без оборудования ESCRT эти белки могут накапливаться и приводить к нейродегенеративным заболеваниям. Например, нарушения в компонентах ESCRT-III могут привести к неврологическим расстройствам, таким как наследственная спастическая параплегия (HSP). [6] Отторжение клеток, процесс, при котором мембрана, соединяющая две дочерние клетки, расщепляется, также опосредован механизмом ESCRT. Без комплексов ESCRT дочерние клетки не могли бы разделяться, и возникали бы аномальные клетки, содержащие вдвое больше ДНК . Эти клетки неизбежно будут уничтожены посредством процесса, известного как апоптоз . Наконец, вирусное почкование или процесс выхода определенных типов вирусов из клеток может не происходить в отсутствие механизма ESCRT. Это неизбежно предотвратит распространение вирусов от клетки к клетке.

Каждый из комплексов ESCRT и вспомогательные белки имеют уникальную структуру, обеспечивающую различные биохимические функции. Для каждого белкового компонента механизма ESCRT существует ряд синонимов как у дрожжей, так и у многоклеточных животных . Сводная таблица всех этих белков представлена ниже.
У дрожжей существуют следующие комплексы/вспомогательные белки:
Комплекс ESCRT-0 играет жизненно важную роль в образовании мультивезикулярных телец путем связывания и кластеризации убиквитинированных белков и/или рецепторов на поверхности клетки. Затем комплекс отвечает за связывание с липидом на эндосомальной мембране, который рекрутирует эти меченые белки в эндосому. [7] После правильной локализации эти белки затем попадают в эндосому через везикулы, образуя мультивезикулярные тельца, и в конечном итоге доставляются в лизосому, где они разрушаются. Этот процесс важен, поскольку он является основным путем деградации поврежденных белков, прошедших через Гольджи . [5] Компоненты комплекса ESCRT-0 существуют следующим образом:
Комплекс представляет собой гетеродимер 1:1 Vps27 ( белок 27, сортирующий вакуолярный белок ) и Hse1 . [1] [6] Vps27 и Hse1 димеризуются через антипараллельные спиральные домены GAT (названные так в честь белков GGA и Tom1). [1] И Vps27, и Hse1 содержат аминоконцевой домен VHS (названный так потому, что он содержится в белках V ps27, H RS и S TAM). [8] Эти домены VHS связывают убиквитин с белками, которые клетка стремится разрушить. Убиквитин также может ассоциироваться с мотивами, взаимодействующими с убиквитином, такими как мотив Hse1 или двухсторонний домен, обнаруженный на Vps27. Домен FYVE (названный в честь четырех белков, в которых он был первоначально идентифицирован: Fab1p, YOTB, Vac1 и EEA1) находится между VHS и взаимодействующими с убиквитином мотивными доменами Vps27. [6] [9] Фосфатидилинозит-3-фосфат , общий эндосомальный липид, связывается с этим доменом FYVE, что приводит к привлечению ESCRT-0 в эндосому. [6]
Роль комплекса ESCRT-I заключается в содействии образованию мультивезикулярных телец путем кластеризации убиквитинированных белков и действия в качестве моста между комплексами ESCRT-0 и ESCRT-II. [10] Он также играет роль в распознавании и ремоделировании мембраны во время отделения мембраны, образуя кольца по обе стороны от среднего тела делящихся клеток. ESCRT-I также отвечает за рекрутирование ESCRT-III, который формирует зону сужения непосредственно перед разделением клеток. [11] Кроме того, ESCRT-I играет роль в почковании вируса, взаимодействуя со специфическими вирусными белками, что приводит к привлечению дополнительных механизмов ESCRT к потенциальному месту высвобождения вируса. [12] Подробности оборудования ESCRT-I описаны ниже.
Комплекс ESCRT-I представляет собой гетеротетрамер (1:1:1:1) Vps23, Vps28 , Vps37 и Mvb12. [3] Собранный гетеротетрамер выглядит как палочковидный стебель, состоящий из Vps23, Vps37 и Mvb12, с веерообразной крышкой, состоящей из одиночных спиралей Vps23, Vps28 и Vps37. [3] [ 6 ] Vps23 содержит один вариантный домен убиквитина E2, который отвечает за связывание убиквитина, комплекса ESCRT-0 и PTAP ( пролин , треонин , аланин , пролин ) мотив вирусного Gag. белки . [3] [6] Сразу после этого вариантного домена убиквитина E2 присутствует богатый пролином мотив (GPPX 3 Y), который направляет ESCRT-I к среднему телу во время отторжения мембраны. [6] Mvb12 также может связывать убиквитин через свой карбокси-конец . Vps28 отвечает за взаимодействие ESCRT-I и ESCRT-II путем ассоциации с доменом GLUE ( GRAM - подобное U -связывание бикитина в E AP45) Vps36 через его карбокси-концевой четырехспиральный домен пучка. [1]
Комплекс ESCRT-II функционирует преимущественно во время биогенеза мультивезикулярных телец и доставки белков, меченных убиквитином, в эндосому. Белки, меченные убиквитином, передаются из ESCRT-0 в ESCRT-I, а затем в ESCRT-II. ESCRT-II соединяется с ESCRT-III, который закрывает груз, содержащий везикулу. [6] Конкретные аспекты ESCRT-II заключаются в следующем:
ESCRT-II представляет собой гетеротетрамер (2:1:1), состоящий из двух субъединиц Vps25 , одной субъединицы Vps22 и одной субъединицы Vps36 . [3] Молекулы Vps25 содержат мотивы PPXY, которые связываются с мотивами крылатой спирали (WH) Vps22 и Vps36, создавая Y-образный комплекс с Vps22 и Vps36 в качестве основания и молекулами Vps25 в качестве плеч. [3] [6] Молекулы Vps25 также содержат мотивы WH, которые отвечают за взаимодействие ESCRT-II с ESCRT-III. Vps36 содержит домен GLUE, который связывает фосфатидилинозитол-3-фосфат и Vps28 ESCRT-I. [3] [6] Два домена «цинковых пальцев» встраиваются в домен GLUE дрожжевого Vps36. Один из этих доменов цинковых пальцев связывает карбокси-концевой домен Vps28, а другой ассоциируется с убиквитином. [6]
Комплекс ESCRT-III, вероятно, является наиболее важным из всех механизмов ESCRT, поскольку он играет роль во всех процессах, опосредованных ESCRT. [13] Во время отрыва мембраны и отпочкования вируса ESCRT-III образует длинные нити, которые обвиваются вокруг места сужения мембраны непосредственно перед ее расщеплением. [11] [14] Это опосредование отрыва происходит посредством взаимодействия с комплексом центрального шпидлина . [15] Эти нитевидные структуры также присутствуют во время формирования мультивезикулярных телец и функционируют как кольцеобразный забор, который закупоривает отпочковавшуюся везикулу, чтобы предотвратить выход белков-грузов в цитозоль клетки. [11] ESCRT-III существует и функционирует следующим образом:
Комплекс ESCRT-III отличается от всех других механизмов ESCRT тем, что он существует лишь временно и содержит как существенные, так и несущественные компоненты. [1] [11] Для того чтобы механизм функционировал, основные субъединицы должны собраться в правильном порядке (Vps20, Snf7, Vps24 , затем Vps2). [6] Несущественные субъединицы включают Vps60, Did2 и Ist1. [11] Vps20 инициирует сборку ESCRT-III, действуя как зародыш сборки полимера Snf7. Затем Vps24 объединяется с Snf7, чтобы ограничить комплекс и завербовать Vps2. [1] [3] Затем Vps2 добавляет в комплекс Vps4. [16] Все «свободные» цитозольные формы каждой субъединицы считаются закрытыми. То есть карбокси-концевая часть каждой субъединицы сворачивается сама в себя автоингибирующим образом, стабилизируя мономерные субъединицы. [1] [3] Карбокси-конец большинства субъединиц ESCRT-III, как незаменимых, так и несущественных, содержат мотивы MIM ( MTIT ( взаимодействующий и транспортный домен микротрубочек ) мотивы ) . [17] Эти мотивы ответственны за связывание Vps4 и спастина AAA-АТФазы . [3]
Белки Vps4-Vta1 необходимы для удаления других компонентов ESCRT (обычно ESCRT-III) из мембран после завершения определенного процесса. Ведутся споры о том, расщепляет ли Vps4 комплекс ESCRT-III или реконструирует комплекс так, чтобы один компонент удалялся в определенное время. [12] Считается, что Vta1 действует как активатор Vps4, помогая его сборке и повышая активность AAA-АТФазы. [13] [18] Эти белки функционируют следующим образом:
Субъединицы Vps4 имеют два функциональных домена: аминоконцевой домен MIT и центральный домен AAA-АТФазы. [3] Домен MIT отвечает за взаимодействие Vps4 с доменом MIM Vps2. [1] Домен AAA-ATPase гидролизует АТФ, обеспечивая разборку комплекса ESCRT-III. [11] Такое «очистка» ESCRT-III позволяет переработать все связанные субъединицы для дальнейшего использования. [11] [12] Vta1 представляет собой димерный белок, содержащий один домен VSL (названный так потому, что он обнаружен в белках V ps4 , S BP1 и L IP5), который обеспечивает связывание с Vps4, и домен MIT для связи с ESCRT. -III субъединица Vps60. Было показано, что Vta1, хотя и не является обязательным, помогает в сборке кольца Vps4, ускоряет АТФазную активность Vsp4 и способствует разборке ESCRT-III. [6]
Основная функция Bro1 — рекрутирование деубиквитиназ в комплекс ESCRT-III. [19] Это приводит к удалению меток убиквитина из белков, предназначенных для деградации в лизосомах непосредственно перед образованием мультивезикулярных телец. Также предполагалось, что Bro1 помогает стабилизировать ESCRT-III, в то время как метки убиквитина отщепляются от грузовых белков. [19]
Bro1 содержит аминоконцевой домен Bro1, который связывается с Snf7 ESCRT-III. [20] Это связывание приводит Bro1 к месту отрыва мембраны. Bro1 также связывает каталитический домен Doa4, убиквитингидролазы (деубиквитиназы), доставляя его к месту отторжения. Doa4 удаляет убиквитин из грузовых белков, направляемых в лизосому. [20]
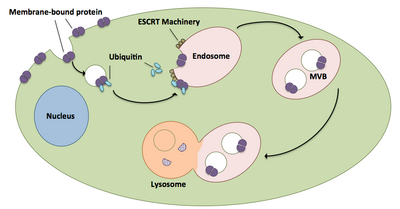
Мультивезикулярные тельца играют большую роль в транспорте убиквитинированных белков и рецепторов к лизосоме. [21] Комплексы ESCRT транспортируют убиквитинированный груз в клеточные везикулы, которые отпочковываются непосредственно в эндосомальный компартмент клетки, образуя мультивезикулярные тельца. [21] Эти мультивезикулярные тельца в конечном итоге сливаются с лизосомой, вызывая деградацию груза. [16] Более подробное описание процесса, включая связанное с ним оборудование, существует следующим образом:

Отрыв мембраны во время цитокинеза — это процесс, при котором мембрана, соединяющая две дочерние клетки, расщепляется во время клеточного деления . Поскольку он консервативен у ряда архей , отторжение мембраны считается самой ранней ролью механизма ESCRT. [6] Процесс начинается, когда центросомный белок Cep55 рекрутируется в среднюю часть делящихся клеток в сочетании с MKLP1, митотическим кинезин -подобным белком, который связывается с микротрубочками. [6] [23] Затем Cep55 рекрутирует субъединицу Vps23 ESCRT-I и вспомогательный белок ALIX, которые формируются в кольца по обе стороны от среднего тела. [6] [11] [12] ESCRT-I и ALIX рекрутируют ESCRT-III через его субъединицу Snf7. [6] Субъединицы ESCRT-III Vps20, Snf7, Vps24, Vps2 и Did2 образуют спиралевидную фибриллу, примыкающую к кольцам, образованным Vps23. [1] [12] [19] Формирование этой спиралевидной структуры деформирует мембрану, и спастин ААА-АТФазы вводится с помощью Did2 и Ist1, чтобы расщепить микротрубочки, образовавшиеся в середине тела. [12] [19] Затем Vps4 катализирует разборку комплекса ESCRT-III, в результате чего образуются две вновь разделенные дочерние клетки. [19] Процесс отрыва мембраны был описан с использованием белков многоклеточных животных, поскольку этот процесс в большей степени изучен у многоклеточных животных.

Высвобождение вирусных частиц, также известное как вирусное почкование , представляет собой процесс, при котором свободные вирионы высвобождаются изнутри клеток путем захвата механизма ESCRT клетки-хозяина. [1] [14] Ретровирусы , такие как ВИЧ-1 и человеческий Т-лимфотропный вирус , а также ряд вирусов с оболочкой , включая вирус Эбола , требуют механизма ESCRT для выхода из клетки-хозяина. [1] Процесс инициируется вирусными белками Gag, основными структурными белками ретровирусной оболочки, которые взаимодействуют с TSG101 комплекса ESCRT-I и вспомогательным белком ALIX. [12] [13] Субъединицы ESCRT-III (существенны только CHMP4 и CHMP2) [10] рекрутируются в место отпочкования вируса, чтобы сжать и перерезать шейку зачатка способом, аналогичным описанному для отрыва мембраны во время цитокинеза. . [1] [6] [12] Затем Vps4 перерабатывает компоненты ESCRT-III в цитозоль, и вирус высвобождается из клетки. [6] В описанном здесь механизме используются белки многоклеточных животных, поскольку почкование вирусов более подробно изучалось у многоклеточных животных.