В органической химии альдольное присоединение Мукаямы — это органическая реакция и тип альдольной реакции между эфиром силил енола ( R 2 C=CR−O−Si(CH 3 ) 3 ) и альдегидом ( R−CH=O ) или формиатом ( R−O−CH=O ). [1] Реакция была открыта Теруаки Мукаямой в 1973 году. [2] Его выбор реагентов позволяет проводить перекрестную альдольную реакцию между альдегидом и кетоном ( >C=O ) или другим альдегидом без самоконденсации альдегида. По этой причине реакция широко используется в органическом синтезе .
Альдольное присоединение Мукаямы представляет собой опосредованное кислотой Льюиса присоединение енольных силанов к карбонильным ( C=O ) соединениям. В этой реакции могут использоваться соединения с различными органическими группами (см. исходные вещества). [3] Базовая версия ( R 2 = H) без присутствия хиральных катализаторов показана ниже.

Образуется рацемическая смесь энантиомеров . Если в этой реакции используются Z- или E-енольные силаны, то образуется смесь четырех продуктов, дающая два рацемата.

Образование анти - диастереомера или син -диастереомера во многом зависит от условий реакции, субстратов и кислот Льюиса.
Архетипичной реакцией является реакция силилового енольского эфира циклогексанона , (CH 2 ) 5 CO , с бензальдегидом , C 6 H 5 CHO . При комнатной температуре образуется диастереомерная смесь трео (63%) и эритро (19%) β- гидроксикетона , а также 6% экзоциклического продукта конденсации енона . В своем первоначальном объеме кислота Льюиса ( тетрахлорид титана , TiCl 4 ) использовалась в стехиометрических количествах, но существуют также и действительно каталитические системы. Реакция также оптимизирована для асимметрического синтеза .
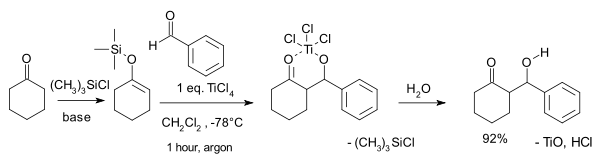
Ниже показан механизм реакции с R 2 = H:
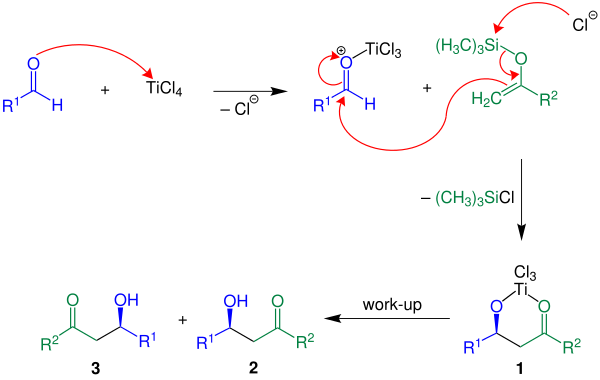
В приведенном примере используется кислота Льюиса TiCl 4. Сначала кислота Льюиса активирует альдегидный компонент, после чего следует образование связи углерод-углерод между енолом силаном и активированным альдегидом. С потерей хлорсилана образуется соединение 1. Желаемый продукт, рацемат 2 и 3 , получают путем водной обработки. [3]
Альдольная реакция Мукаямы не следует модели Циммермана-Тракслера. Каррейра описал особенно полезную асимметричную методологию с ацеталями силилкетена, примечательную своими высокими уровнями энантиоселективности и широким спектром субстратов. [4] Метод работает с неразветвленными алифатическими альдегидами, которые часто являются плохими электрофилами для каталитических асимметричных процессов. Это может быть связано с плохой электронной и стерической дифференциацией между их энантиофасами .
Аналогичный винилогический альдольный процесс Мукаямы также может быть сделан каталитическим и асимметричным. Пример, показанный ниже, работает эффективно для ароматических (но не алифатических) альдегидов, и механизм, как полагают, включает хиральный, связанный с металлом диенолят. [5] [6]
Типичная реакция с участием двух кетонов – это реакция между ацетофеноном в качестве енола и ацетоном : [7]

Реакции кетонов этого типа требуют более высоких температур реакции. Для этой работы Мукаяма был вдохновлен более ранней работой, выполненной Георгом Виттигом в 1966 году по перекрестным альдольным реакциям с литированными иминами . [8] [9] Конкурирующая работа с альдольными реакциями енолята лития была опубликована также в 1973 году Гербертом О. Хаусом. [10]
Мукаяма использовал в своей интерпретации полного синтеза таксола (1999) две реакции альдольного присоединения, [11] [12] одна с силилацеталем кетена и избытком бромида магния :

и второй с аминохиральным лигандом и катализатором на основе трифлатной соли :

Использование хиральных комплексов кислот Льюиса и оснований Льюиса в асимметричных каталитических процессах является наиболее быстрорастущей областью использования альдольной реакции Мукаямы. [3]