Существует несколько известных аллотропов кислорода . Наиболее известным является молекулярный кислород ( O 2 ), присутствующий в значительных количествах в атмосфере Земли и также известный как дикислород или триплетный кислород . Другой — это высокореактивный озон ( O 3 ). Другие:
Атомарный кислород, обозначаемый O или O 1 , очень реактивен, так как отдельные атомы кислорода имеют тенденцию быстро связываться с близлежащими молекулами. Его электронное состояние с самой низкой энергией - спиновый триплет , обозначаемый термином символ 3 P. На поверхности Земли он существует естественным образом в течение очень короткого времени. В открытом космосе наличие обильного ультрафиолетового излучения приводит к образованию атмосферы на низкой околоземной орбите , в которой 96% кислорода находится в атомарной форме. [1]
Атомарный кислород был обнаружен на Марсе аппаратами Mariner , Viking и обсерваторией SOFIA . [2]
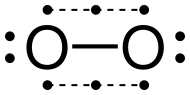
Распространенный аллотроп элементарного кислорода на Земле, O 2 , обычно известен как кислород, но может называться дикислородом , двухатомным кислородом , молекулярным кислородом , диоксиденом или газообразным кислородом , чтобы отличать его от самого элемента и от трехатомного аллотропа озона , O 3 . Как основной компонент (около 21% по объему) атмосферы Земли , элементарный кислород чаще всего встречается в двухатомной форме. Аэробные организмы используют атмосферный дикислород в качестве конечного окислителя в клеточном дыхании для получения химической энергии . Основное состояние дикислорода известно как триплетный кислород , 3 [O 2 ] , потому что он имеет два неспаренных электрона. Первое возбужденное состояние, синглетный кислород , 1 [O 2 ] , не имеет неспаренных электронов и является метастабильным . Дублетное состояние требует нечетного числа электронов и поэтому не может возникнуть в дикислороде без приобретения или потери электронов, как, например, в супероксидном ионе ( O −2) или диоксигенильный ион ( O+2).
Основное состояние O 2 имеет длину связи 121 пм и энергию связи 498 кДж/моль. [3] Это бесцветный газ с температурой кипения −183 °C (90 K; −297 °F). [4] Его можно конденсировать из воздуха путем охлаждения жидким азотом, температура кипения которого −196 °C (77 K; −321 °F). Жидкий кислород имеет бледно-голубой цвет и довольно заметно парамагнитен из-за неспаренных электронов; жидкий кислород, содержащийся в колбе, подвешенной на нити, притягивается к магниту.
Синглетный кислород — это общее название двух метастабильных состояний молекулярного кислорода ( O 2 ) с более высокой энергией, чем основное состояние триплетного кислорода . Из-за различий в их электронных оболочках синглетный кислород имеет другие химические и физические свойства, чем триплетный кислород, включая поглощение и излучение света на разных длинах волн. Он может быть получен в фотосенсибилизированном процессе путем передачи энергии от молекул красителей, таких как бенгальский розовый , метиленовый синий или порфирины , или в результате химических процессов, таких как спонтанное разложение триоксида водорода в воде или реакция перекиси водорода с гипохлоритом .
Трехатомный кислород (озон, O 3 ) является очень реактивным аллотропом кислорода, который представляет собой бледно-голубой газ при стандартной температуре и давлении . Жидкий и твердый O 3 имеют более глубокий синий цвет, чем обычный O 2 , и они нестабильны и взрывоопасны. [5] [6] В своей газовой фазе озон разрушителен для таких материалов, как резина и ткань , и повреждает легочную ткань. [7] Следы его можно обнаружить как резкий, похожий на хлор запах, [4] исходящий от электродвигателей , лазерных принтеров и копировальных аппаратов , поскольку он образуется, когда воздух подвергается электрическому разряду. Он был назван «озоном» в 1840 году Кристианом Фридрихом Шенбейном [ 8] от древнегреческого ὄζειν (ozein: «пахнуть») плюс суффикс -on , обычно использовавшийся в то время для обозначения производного соединения и англицированный как -one . [9]
Озон термодинамически нестабилен и имеет тенденцию реагировать в сторону более распространенной формы дикислорода. Он образуется в результате реакции неповрежденного O 2 с атомарным кислородом, образующимся при расщеплении O 2 УФ-излучением в верхних слоях атмосферы . [5] Озон сильно поглощает ультрафиолет и в стратосфере выполняет функцию щита для биосферы от мутагенных и других разрушительных эффектов солнечного УФ-излучения (см. озоновый слой ). [5] Тропосферный озон образуется вблизи поверхности Земли в результате фотохимического распада диоксида азота в выхлопных газах автомобилей . [10] Приземный озон является загрязнителем воздуха , который особенно вреден для пожилых людей, детей и людей с заболеваниями сердца и легких, такими как эмфизема , бронхит и астма . [11] Иммунная система вырабатывает озон как противомикробное средство (см. ниже). [12]
Циклический озон — это теоретически предсказанная молекула O3 , в которой три атома кислорода связаны в равносторонний треугольник, а не под открытым углом.
Существование тетраоксигена предполагалось с начала 1900-х годов, когда он был известен как оксозон. Он был идентифицирован в 2001 году группой под руководством Фульвио Какаче в Римском университете. [13] Считалось, что молекула O 4 находится в одной из фаз твердого кислорода, позже идентифицированного как O 8 . Группа Какаче предположила, что O 4 , вероятно, состоит из двух гантелеобразных молекул O 2 , свободно удерживаемых вместе индуцированными дипольными дисперсионными силами.
Существует шесть известных различных фаз твердого кислорода. Одна из них — темно-красный кластер O 8 . Когда кислород подвергается давлению 96 ГПа, он становится металлическим , подобно водороду , [14] и становится более похожим на более тяжелые халькогены , такие как селен (имеющий розово-красный цвет в своем элементарном состоянии), теллур и полоний , оба из которых демонстрируют значительный металлический характер. При очень низких температурах эта фаза также становится сверхпроводящей .