Беноксапрофен , также известный как Беноксафен , представляет собой химическое соединение с формулой C16H12ClNO3 . Это нестероидный противовоспалительный препарат ( НПВП) класса пропионовой кислоты , который продавался под торговой маркой Opren в Соединенном Королевстве и Европе компанией Eli Lilly and Company ( обычно именуемой Lilly), а также как Oraflex в Соединенных Штатах Америки (США). Lilly приостановила продажи Oraflex в 1982 году после сообщений британского правительства и Управления по контролю за продуктами и лекарствами США (US FDA) о побочных эффектах и смертельных случаях, связанных с препаратом.
Беноксапрофен был открыт группой химиков-исследователей в British Lilly Research Centre компании Eli Lilly and Company . Эта лаборатория была назначена для исследования новых противоартритных соединений в 1966 году. Спустя семь лет Lilly подала заявку на патенты на свой тогда еще названный новый препарат «беноксапрофен». Она также подала заявку на разрешение от Управления по контролю за продуктами и лекарствами США на начало испытаний беноксапрофена на людях . Он должен был пройти трехэтапную процедуру клинических испытаний , требуемую федеральным правительством Соединенных Штатов. [1]
Lilly начала I фазу клинических испытаний беноксапрофена, протестировав выборку здоровых добровольцев. Эти испытания должны были доказать, что их новый препарат не представляет явной и непосредственной угрозы безопасности. В фазе II было протестировано большее количество людей, включая некоторых с незначительными заболеваниями; эффективность и безопасность препарата были основной целью этих испытаний. Фаза III была самым крупным испытанием и началась в 1976 году. Более 2000 пациентов с артритом получили беноксапрофен от более чем 100 врачей. Затем врачи сообщили результаты в компанию Lilly. [1]
Когда Lilly официально запросила начать маркетинг беноксапрофена в январе 1980 года в FDA США, документ состоял из более чем 100 000 страниц результатов испытаний и записей пациентов. Однако беноксапрофен впервые был продан за рубежом: в 1980 году он был выпущен для маркетинга в Соединенном Королевстве. Впоследствии он появился на рынке в мае 1982 года в США. [2]
Когда беноксапрофен появился на рынке под названием Oraflex в США, для компании Lilly Company появились первые признаки проблем. В мае 1982 года British Medical Journal сообщил, что врачи в Соединенном Королевстве считали, что препарат был ответственен по меньшей мере за двенадцать смертей, в основном из-за почечной и печеночной недостаточности . Была подана петиция с требованием изъять Oraflex с рынка. [1]
4 августа 1982 года британское правительство временно приостановило продажу препарата в Великобритании «по соображениям безопасности». Британский комитет по безопасности лекарственных средств заявил в телеграмме FDA, что получил сообщения о более чем 3500 неблагоприятных побочных эффектах среди пациентов, которые использовали Oraflex. Также было зарегистрировано 61 смерть, большинство из которых были среди пожилых людей. Почти одновременно FDA заявило, что у него есть сообщения об 11 смертях в США среди пользователей Oraflex, большинство из которых были вызваны поражением почек и печени. [1] Компания Eli Lilly приостановила продажу беноксапрофена в тот же день. [1]
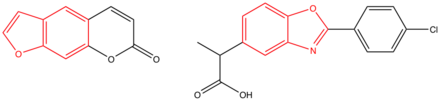
Молекулярная формула беноксапрофена - C16H12ClNO3 , а систематическое название ( ИЮПАК ) - 2-[2-(4-хлорфенил ) -1,3-бензоксазол-5-ил]пропионовая кислота. Молекула имеет молекулярную массу 301,050568 г / моль . [3]
Беноксапрофен по сути является плоской молекулой . Это обусловлено копланарностью бензоксазольного и фенильного колец , но молекула также имеет неплоскую боковую цепь, состоящую из фрагмента пропановой кислоты , который действует как группа-носитель. Эти результаты были получены в результате рентгеновских кристаллографических измерений, проведенных в исследовательском центре Лилли. [4]
Беноксапрофен очень фототоксичен . Свободнорадикальное декарбоксилированное производное препарата является токсичным агентом , который в присутствии кислорода дает синглетный кислород и супероксид-анион. Облучение беноксапрофена в водном растворе вызывает фотохимическое декарбоксилирование через радикальный механизм и одноцепочечные разрывы ДНК . Это также происходит с кетопрофеном и напроксеном , другими НПВП, которые еще более активны в этом отношении, чем беноксапрофен. [4]
Беноксапрофен представляет собой рацемическую смесь [(RS)-2-(п-хлорфенил-a-метил-5-бензоксазолуксусная кислота]. Двумя энантиомерами являются R(-) и S(+). [5]
Инверсия R(-) энантиомера и сопряжение глюкуронида метаболизируют беноксапрофен. Однако беноксапрофен не будет легко подвергаться окислительному метаболизму. [4]
Однако возможно, что когда цитохром P4501 является катализатором, происходит оксигенация 4-хлорофиллового кольца. С S(+) энантиомером более вероятно, что происходит оксигенация ароматического кольца фрагмента 2-фенилпропионовой кислоты, здесь также катализатором является цитохром P4501. [4]
Беноксапрофен хорошо всасывается после перорального приема доз от 1 до 10 мг / кг . В плазме обнаруживается только неизмененный препарат , в основном связанный с белками плазмы. Уровни беноксапрофена в плазме у одиннадцати субъектов были точно предсказаны на основе двухкамерной открытой модели. Средний период полувыведения всасывания составил 0,4 часа. Это означает, что в течение 25 минут половина дозы всасывается в систему. Средний период полувыведения распределения составил 4,8 часа. Это означает, что в течение 5 часов половина дозы распределяется по всей системе. Средний период полувыведения составил 37,8 часа. Это означает, что в течение 40 часов половина дозы выводится из системы. [6]
У самок крыс после пероральной дозы 20 мг/кг концентрация беноксапрофена в тканях была самой высокой в печени, почках, легких, надпочечниках и яичниках. Распределение у беременных самок такое же, хотя его также можно обнаружить, в более низких концентрациях, у плода. Существует большая разница между видами в путях выведения. У человека, макаки-резуса и кролика он в основном выводится через мочу , в то время как у крысы и собаки он выводился через желчно - фекальную экскрецию . У человека и собаки соединение выводилось в виде эфирного глюкуронида, а у других видов - в неизмененном виде. Это означает, что не происходит никакой значительной метаболической трансформации беноксапрофена. [7]
В отличие от других нестероидных противовоспалительных препаратов , беноксапрофен действует непосредственно на мононуклеарные клетки . Он подавляет их хемотаксический ответ, ингибируя фермент липоксигеназу . [8]
Беноксапрофен — анальгетик , жаропонижающее и противовоспалительное средство. [9] Беноксапрофен назначался пациентам с ревматоидным артритом и остеоартритом из-за его противовоспалительного эффекта. Пациенты с болезнью Педжета , псориатическим артритом , анкилозирующим спондилитом , болезненным плечом, смешанным заболеванием соединительной ткани, ревматической полимиалгией , болью в спине и болезнью Бехчета также получали беноксапрофен. Ежедневная доза 300–600 мг эффективна для многих пациентов. [10]
Существуют различные типы побочных эффектов . Большинство из них были кожными или желудочно-кишечными . Побочные эффекты редко появляются в центральной нервной системе , и различные побочные эффекты не часто наблюдались. Исследование показывает, что большинство побочных эффектов появляются у пациентов с ревматоидным артритом [10]
Кожные побочные эффекты беноксапрофена включают фотосенсибилизацию , онихолизис , сыпь , милиумы , усиленный рост ногтей, зуд ( зуд ) и гипертрихоз . [10] Фотосенсибилизация приводит к жжению, зуду или покраснению, когда пациенты подвергаются воздействию солнечного света. [11] Исследование показывает, что беноксапрофен или другие агенты, ингибирующие липоксигеназу , могут быть полезны при лечении псориаза, поскольку ингибируют миграцию воспалительных клеток ( лейкоцитов ) в кожу. [12]
Побочные эффекты беноксапрофена со стороны желудочно-кишечного тракта включают кровотечение, диарею, боли в животе, анорексию , язвы во рту и изменение вкуса. [10] [13] Согласно исследованию, наиболее выраженными побочными эффектами со стороны желудка являются рвота , изжога и боли в эпигастрии . [10]
У небольшого числа людей прием беноксапрофена может вызвать депрессию , вялость и плохое самочувствие. [10]
У пациентов, принимающих беноксапрофен, редко возникают слабость, головокружение, головная боль , сердцебиение, носовое кровотечение , нечеткость зрения, позывы к мочеиспусканию и гинекомастия . [10]
Беноксапрофен также может вызывать гепатотоксичность , что приводило к смерти некоторых пожилых пациентов. [14] [15] Это было основной причиной, по которой беноксапрофен был изъят с рынка.
После приостановки продаж в 1982 году токсические эффекты, которые беноксапрофен мог оказывать на людей, были изучены более глубоко. Довольно плоское соединение беноксапрофена, по-видимому, является гепа- и фототоксичным в организме человека. [4]
Беноксапрофен имеет довольно длительный период полувыведения у человека (t 1/2 = 20-30 часов), подвергается желчной экскреции и энтерогепатической циркуляции , а также, как известно, имеет медленный плазменный клиренс (CL p = 4,5 миллилитра в минуту). Период полувыведения может быть еще больше увеличен у пожилых пациентов (> 80 лет) и у пациентов, которые уже имеют почечную недостаточность; увеличиваясь до цифр до 148 часов. [4]
Гепатотоксичность беноксапрофена для плода может быть обусловлена накоплением препарата после повторной дозировки, а также связана с медленным клиренсом плазмы . Накопление препарата в печени, предположительно, является причиной повышения активности печеночного цитохрома P450I, который будет оксигенировать бенаксопрофен и производить реактивные промежуточные продукты. Беноксапрофен, скорее всего, является субстратом и слабым индуктором цитохрома P450I и его семейства ферментов. Обычно он не метаболизируется окислительными реакциями, но с S(+) энантиомером беноксапрофена и цитохромом P450I в качестве катализатора, оксигенация 4-хлорфенильного кольца и ароматического кольца 2-фенилпропионовой кислоты, по-видимому, возможна. Таким образом, индукция второстепенного метаболического пути приводит к образованию токсичных метаболитов в значительных количествах. Токсичные метаболиты могут связываться с жизненно важными внутриклеточными макромолекулами и могут генерировать реактивный кислород путем окислительно-восстановительного цикла , если образуется хинон . [4] Это также может привести к истощению защитного глутатиона , который отвечает за детоксикацию реактивного кислорода. [16]
Наблюдаемая фототоксичность кожи у пациентов, лечившихся беноксапрофеном, может быть объяснена, если взглянуть на структуру соединения. Существует значительное структурное сходство между бензоксазольным кольцом беноксапрофена и бензофурановым кольцом псоралена , соединением, которое известно как фототоксичное. Свободное декарбоксилированное производное препарата может производить синглетный кислород и супероксидные анионы в присутствии кислорода. Кроме того, возможными объяснениями фотохимического декарбоксилирования и образования кислородных радикалов могут быть накопление повторных доз, индукция цитохрома P450I и возникновение реактивных промежуточных продуктов с ковалентной связью. Фотохимический характер соединения может вызывать воспаление и серьезное повреждение тканей. [4]
У животных также наблюдается пролиферация пероксисом, но у человека она, по-видимому, незначительна. [4]
Эффекты беноксапрофена на животных были проверены в серии экспериментов. [7] [17] Беноксапрофен оказывал значительное противовоспалительное , анальгезирующее , а также жаропонижающее действие в этих тестах. [7] У всех шести испытуемых животных, включая крыс, собак, макак-резусов , кроликов, морских свинок и мышей, препарат хорошо всасывался перорально. У трех из шести видов беноксапрофен затем эффективно всасывался из желудочно-кишечного тракта (после перорального приема доз 1–10 мг / кг ). [7] Было обнаружено, что период полувыведения из плазмы был различным, составляя менее 13 часов у собак, кроликов и обезьян, и был заметно дольше у мышей. Кроме того, были обнаружены видовые различия в скорости и пути выведения соединения. В то время как беноксапрофен выводился с мочой у кроликов и морских свинок, выведение с желчью было способом выведения, обнаруженным у крыс и собак. У всех видов в плазме был обнаружен только неизмененный беноксапрофен, в основном связанный с белками. [7]
Выведение неизмененного соединения в желчь происходило медленнее у крыс. Это интерпретируется авторами как доказательство того, что энтерогепатическая циркуляция не происходит. [7] Другое исследование на крысах показало, что плазматическая мембрана гепатоцитов начала формировать пузырьки после введения беноксапрофена. Предполагается, что это связано с нарушениями концентрации кальция , что, возможно, является результатом измененного окислительно-восстановительного состояния клеток, которое может влиять на функцию митохондрий и, следовательно, вызывать нарушения концентрации кальция. [17] Ни у одного из видов не было обнаружено значительных уровней метаболизма беноксапрофена. Только у собак глюкуронид можно было обнаружить в желчи, что является верным признаком метаболизма у этого вида. Кроме того, не было обнаружено никаких различий в распределении соединения у нормальных и беременных крыс. Было показано, что у крыс беноксапрофен распределялся в плод, но с заметно более низкой концентрацией, чем в материнской ткани. [7]
Реакция Зандмейера путем диазотирования 2-(4-аминофенил)пропаннитрила (1) с последующим кислотным гидролизом приводит к фенолу (2), который нитруется и восстанавливается путем каталитического гидрирования , давая аминофенол (3). Гидролиз нитрила и этерификация производят эфир (4), который преобразуется в беноксапрофен путем ацилирования с п- хлорбензоилхлоридом с последующей циклизацией и омылением этилового эфира. [18] [19] [20]