Нонахлорид трирения — это соединение с формулой ReCl 3 , иногда также записываемое как Re 3 Cl 9 . Это темно-красное гигроскопичное твердое вещество, нерастворимое в обычных растворителях. Соединение играет важную роль в истории неорганической химии как ранний пример кластерного соединения со связями металл-металл. [1] Оно используется в качестве исходного материала для синтеза других комплексов рения.
Как показала рентгеновская кристаллография, трирениум нонахлорид состоит из субъединиц Re 3 Cl 12 , которые делят три хлоридных мостика с соседними кластерами. Взаимосвязанная сеть кластеров образует листы. Вокруг каждого центра Re находятся семь лигандов, четыре мостиковых хлорида, один терминальный хлорид и две связи Re-Re. [2]
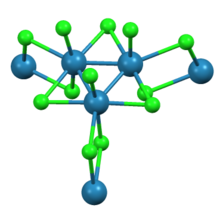
Гидрат является молекулярным с формулой Re 3 Cl 9 (H 2 O) 3 . [3]
Теплота окисления оценивается по уравнению:
Энтальпия этого процесса составляет 190,7 ± 0,2 ккал/моль. [2]
Соединение было открыто в 1932 году. [4] Нонахлорид трирения эффективно получается путем термического разложения пентахлорида рения или гексахлорреновой (IV) кислоты: [5]
Если образец подвергается вакуумной сублимации при 500 °C, полученный материал сравнительно нереакционноспособен. Частично гидратированный материал, такой как Re 3 Cl 9 (H 2 O) 4 [6], может быть более полезен в синтетическом плане. Другие синтетические методы включают обработку рения сульфурилхлоридом . Этот процесс иногда проводят с добавлением хлорида алюминия . [ 2] Его также получают нагреванием Re 2 (O 2 CCH 3 ) 4 Cl 2 в присутствии HCl:
Реакция три- и пентахлоридов дает тетрахлорид рения :