SARS-CoV-2 , возбудитель COVID-19 , впервые попал к человеку через зооноз (передача возбудителя человеку от животного), и зоонозное распространение является причиной возникновения COVID-19 , которую научное сообщество считает наиболее правдоподобной. [a] Человеческие коронавирусы , включая SARS-CoV-2, являются зоонозными заболеваниями, которые часто приобретаются через распространение инфекции от животных. [2]
Предыдущее появление SARS-CoV-1 и MERS-CoV показало, что бета-коронавирусы представляют риск возникновения заболеваний, угрожающих человеку. [3] [4] Возросшая осведомленность из-за вспышки атипичной пневмонии в 2002–2004 годах мотивировала исследования потенциала других вспышек коронавирусов и животных-резервуаров , которые могут привести к ним. [5] Известно, что летучие мыши, в частности, являются носителями устойчивых популяций коронавирусов, и в условиях устойчивой инфекции коронавирусы имеют тенденцию накапливать мутации, которые позволяют их доменам связывания рецепторов взаимодействовать с межвидовыми ортологами целевых рецепторов . [ 6] На основании серологических и молекулярных исследований китайские подковоносы были идентифицированы как наиболее вероятный резервуар для SARS-CoV-1. [7] Летучие мыши также были вероятным резервуаром для родственного бета-коронавируса MERS-CoV , хотя доказательства этого менее убедительны, чем роль верблюдов как резервуара для MERS. [8] К 2010 году эксперименты in vitro подтвердили, что модификации домена связывания рецептора спайкового белка могут сделать возможным инфицирование человека несколькими коронавирусами, связанными с SARS. [9] Вирусологи Рэйчел Грэм и Ральф С. Барик в то время писали, «что вопрос о появлении другого патогенного человеческого коронавируса из резервуаров летучих мышей может быть более уместно выражен как «когда», а не как «если». [10] [ требуется лучший источник ]
Вероятное происхождение SARS-CoV-2 от летучих мышей совпадает с происхождением других коронавирусов в его роде Betacoronavirus , подрод Sarbecovirus . [11] [12] [13] [14] У нескольких видов летучих мышей есть особые клеточные механизмы для сопротивления провоспалительным цитокинам, связанным с вирулентностью Betacoronavirus , [15] например, шиповидные белки в коронавирусах, связанных с SARS, коэволюционируют с рецепторами ACE2 летучих мышей в эволюционной гонке вооружений. [16]

Летучие мыши, вместе с их вирусами, имеют большие перекрывающиеся географические ареалы в Юго-Восточной Азии, [17] и особенно большая концентрация и разнообразие коронавирусов, связанных с летучими мышами, наблюдается в Южном и Юго-Западном Китае. [15] Наиболее похожие известные вирусы на SARS-CoV-2 включают коронавирусы летучих мышей RpYN06 с 94,5% идентичности, [15] и RmYN02 с 93% идентичности [18] RaTG13 не был прямым предшественником SARS-CoV-2. [19] Теммам и др. не обнаружили серологических доказательств воздействия BANAL-52 среди обработчиков летучих мышей и сборщиков гуано в районе Лаоса , где он был отобран. [20] Литрас и др. написали, что «SARS-CoV-2 можно однозначно проследить до подковоносых летучих мышей». [21] Они подсчитали, что последние общие предки SARS-CoV-2 с RmYN02 и RaTG13 разошлись 40 и 50 лет назад соответственно. [22]
Рецепторный связывающий домен белка-шипа SARS-CoV-2 имеет вставку аминокислот между субъединицами S1 и S2. [ 23] Среди сарбековирусов только SARS-CoV-2 и RmYN02 имеют такую вставку, что предполагает различия в видах-резервуарах, промежуточных хозяевах или эволюционном пути. [18] Рецепторный связывающий мотив — это часть SARS-CoV-2, которая больше всего отличается от RaTG13. [24] Рецепторный связывающий домен SARS-CoV-2 больше похож на таковые у коронавирусов панголина . [18] Вирусы, включая BANAL-52, выделенные от летучих мышей в Лаосе, показали высокое сходство с доменом связывания рецептора SARS-CoV-2 по аминокислотным остаткам, но менее 76,4% нуклеотидной идентичности по всему белку-шипу. [2] Наблюдаемое связывание N-ацетилнейраминовой кислоты NTD [25] спайкового белка и потеря этого связывания из-за мутации соответствующего кармана связывания сахара в возникающих вариантах, вызывающих беспокойство, предполагает потенциальную роль временного связывания сахара в зоонозном заболевании SARS-CoV-2, что согласуется с предыдущими эволюционными предположениями. [26]
В пределах рода Betacoronavirus сайты расщепления фурином распространены в подродах Merbecovirus и Embecovirus . [27] Сайты расщепления фурином независимо развивались шесть раз в различных кладах Betacoronavirus. [27] Сайты расщепления фурином также развивались в Alphacoronaviruses и Gammacoronaviruses независимо от Betacoronavirus. [27]

Расщепление фурином вносит значительный вклад в трансмиссивность и патогенность SARS-CoV-2 у людей. [28] Варианты SARS-CoV-2, в которых отсутствует сайт расщепления фурином, передаются между людьми, но гораздо менее эффективно. [29] Сайт расщепления фурином иногда описывается как «многоосновный» из-за его особого мотива основных аминокислот. [28] SARS-CoV-2 разделяет аминокислотную идентичность с сайтом расщепления фурином α-субъединицы человеческого ENaC . [30] [31] [b] Человеческий ENaC идентичен только таковому у нескольких человекообразных обезьян и Pipistrellus kuhli . [32]
SARS-CoV-2 также отличается от человеческих коронавирусов тем, что имеет один неповрежденный ген ORF8, а не субъединицы «a» и «b». [1]
SARS-CoV-2 имеет расширенный круг хозяев по сравнению с SARS-CoV-1 и MERS-CoV. [33] [34] SARS-CoV-2 (вместе с SARS-CoV-1 и MERS-CoV) являются вирусами общего профиля, не адаптированными специально для людей, что означает, что они могут распространяться на многие виды и создавать новые естественные резервуары после адаптивных эволюционных изменений. [35]
В пределах одного хозяина возникает множество однонуклеотидных вариаций посредством случайных мутаций и генетического дрейфа, что приводит к появлению вирусных квазивидов . [36] SARS-CoV-2 мутирует медленнее, чем это типично для РНК-вирусов. [36] Основным источником мутаций, обусловленным хозяином, является редактирование белками APOBEC . [36] Отрицательный отбор иммунными процессами хозяина вызывает конвергентную эволюцию в направлении иммунного ускользания. [36] Устойчивость инфекции коррелирует с разнообразием квазивидов, но направление причинно-следственной связи для этого неизвестно. [36]
Фактическая восприимчивость хозяина может значительно отличаться от предсказаний in silico . [35] [37] Процесс адаптации хозяина изучался на гуманизированных мышах , а также путем создания адаптированных к мышам вирусных штаммов посредством серийного пассажа . [38] Дикие мыши лишь слабо восприимчивы к исходному штамму SARS-CoV-2. [38]
По сравнению с другими одноцепочечными РНК-вирусами коронавирусы имеют повышенную тенденцию к генетической рекомбинации , что позволяет им обмениваться генетическим материалом с близкими родственниками, коинфицирующими тот же организм. [39] Считается, что происхождение SARS-CoV-1 связано с множественными событиями рекомбинации. [40] Рекомбинация между штаммами SARS-CoV-1 является обычным явлением. [41] Предполагаемые филогении коронавирусов, связанных с SARS2, могут быть объяснены рекомбинацией. [42] Сообщалось о рекомбинации между различными вариантами SARS-CoV-2, вызывающими беспокойство . [43]

Литрас и др. определили открытую рамку считывания шипа SARS-CoV-2 как горячую точку рекомбинации. [44] Они предполагают, что геном SARS-CoV-2 может включать в себя повторяющиеся события рекомбинации, перепечатывающие области, которые сами по себе уже были продуктами рекомбинации. [45] Теммам и др. писали, что из-за ограниченной диффузии вирусов летучих мышей среди млекопитающих, коинфекция, необходимая для рекомбинации у млекопитающих, маловероятна. [46] Поэтому они посчитали более вероятным, что сайт расщепления фурина возник в резервуаре летучих мышей до распространения.
После межвидовой передачи вируса ожидается быстрая эволюция и положительный отбор . [47] Несколько исследований обнаружили только слабые признаки адаптивной эволюции на ранней стадии пандемии COVID-19. [c] Кан и др. писали, что к 2021 году SARS-CoV-2 продемонстрировал относительно небольшую генетическую изменчивость . [47] Тай и др. писали, что расширение популяции, а не положительный отбор, объяснило спектр частот мутаций во время ранней пандемии. [49] Кальяни и др. писали, что геном SARS-CoV-2 в целом демонстрирует доказательства очищающего отбора «от сильного до умеренного» . [50] Дополнительные открытые рамки считывания , особенно ORF8, показали слабый или нейтральный отбор. Общее отсутствие положительного отбора во время ранней вспышки SARS-CoV-2 контрастировало с эволюционным ходом SARS-CoV-1. [51]
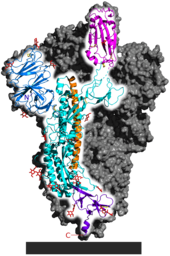
Однако были обнаружены убедительные доказательства положительного отбора в субъединице S1 шиповидного белка, которая содержит домен связывания рецептора. [24] [52]
Нестабильность генома в белке шипа типична для коронавирусов в целом, способствуя образованию многочисленных вариантов белка шипа. [43] Домен связывания рецептора является значимым фактором тропизма хозяина или разнообразия видов, которые может инфицировать вирус. [53] [54] Адаптация коронавируса к новому хозяину часто требует мутаций в домене связывания рецептора. [55] Канг и др. выявили полиморфизм одного нуклеотида относительно RaTG13 в белке шипа, постоянный среди всех более чем 180 000 образцов SARS-CoV-2, влияющий на гликозилирование домена связывания рецептора. [56] Используя систему обратной генетики для создания мутанта, похожего на предкового, они подтвердили, что предполагаемая предковая форма этого SNP была гораздо менее передаваемой в клетках человека. [57]
Большинство сарбековирусов не зависят от ACE2 для проникновения в клетку. [58] Го и др. делят сарбековирусы на четыре клады, первая из которых — респираторные вирусы, использующие ACE2, включая SARS-CoV-1, SARS-CoV-2 и WIV1. По сравнению с кладой 1, клады 3 и 4 имеют делецию одного остатка в домене связывания рецептора и сниженную способность использовать ACE2. Клада 2 имеет две делеции и не взаимодействует с ACE2. Клады 2–4 сложнее изолировать или размножать в клеточной культуре, и, следовательно, они были менее изучены. Независимая от ACE2 инфекция сарбековирусами зависит от высоких уровней трипсина , пищеварительного белка, в среде хозяина. Трипсин может компенсировать другие отсутствующие или совместимые протеазы хозяина. Повсеместность фурина по сравнению с трипсином позволила бы получить сайт расщепления фурина для расширения тропизма вирусной ткани. [59] Го и др. идентифицировали клады 1 и 2 сарбековирусов в образцах фекалий Rhinolophus , предполагая, что оба типа естественным образом реплицируются в пищеварительном тракте летучих мышей. [58] У летучих мышей с инфекциями, подобными SARS, в дикой природе не наблюдалось репликации вируса в респираторных каплях. [60] Фекально-оральная передача является альтернативным путем для некоторых респираторных вирусов. [58] Не было зарегистрировано более высокой заболеваемости сарбековирусами у рабочих, которые вступали в прямой контакт с гуано. [13] Теммам и др. обнаружили, что BANAL-236, вирус, связанный с SARS-CoV-2, выделенный от летучих мышей в Лаосе, действует как кишечный вирус у макак . [61]
В отличие от SARS-CoV-1, первоначальная вспышка SARS-CoV-2 была зарегистрирована только в одном городе. [62] Китайский эпидемиологический надзор не зафиксировал никаких других вспышек пневмонии осенью 2019 года. [63] Грэм и Барик написали, что в случае SARS-CoV-1 популяции вируса циркулировали и адаптировались к циветтам и людям в течение двух лет до признанной вспышки. [60]
Передача SARS-CoV-2 от человека к животным, известная как обратный зооноз или антропоноз, возможна. [64] Обратное зоонозное или экспериментальное заражение SARS-CoV-2 было зарегистрировано у 31 вида животных. [65] Не считается, что дикая природа играет значительную роль в продолжающейся циркуляции SARS-CoV-2 среди людей. [66]
.jpg/440px-DSC_0377_(8413679878).jpg)
Варианты SARS-CoV-2, адаптированные к норкам, были обнаружены совместно циркулирующими среди людей и выращиваемых норок. [2] Норки — единственные животные в Европе или Северной Америке, которые пережили широкомасштабные вспышки SARS-CoV-2. Передача от человека к норкам происходила многократно, в большинстве случаев не приводя к устойчивой вспышке у норок. [51] Были получены убедительные доказательства положительного отбора у норок после распространения, сосредоточенного в мотиве связывания рецепторов. [67]
Передача вируса обратно человеку была задокументирована для норок, хомяков и кошек. [66] Предполагается передача вируса человеку от оленей. [66] Подтверждена передача SARS-CoV-2 среди домашних кошек . [68]
Ли и др. написали, что SARS-CoV-2 может быть менее способен передаваться от человека к животным, чем SARS-CoV-1. [54]
Во время вспышки SARS-CoV-1 возможными переносчиками были пальмовые циветты, енотовидные собаки, хорьковые барсуки, рыжие лисицы, домашние кошки и рисовые полевые крысы. [7] Грэм и Барик писали, что инфекции у людей и циветт, вероятно, произошли от неизвестного общего предшественника. [69] Патрик Берче писал, что возникновение SARS-CoV-1 и MERS-CoV, по-видимому, было последовательными процессами, включающими промежуточных хозяев, коинфекции и рекомбинацию. [70] В отличие от быстрой идентификации животных-хозяев для SARS-CoV-1 и MERS-CoV, прямого животного-источника для SARS-CoV-2 обнаружено не было. [71] Холмс и др. писали, что отсутствие промежуточного хозяина, вероятно, связано с тем, что подходящее животное до сих пор не было протестировано. [19] Фрутос и др. предположили, что SARS-CoV-2 возник не в результате дискретного распространения, а в соответствии с моделью циркуляции, включающей многократный горизонтальный перенос среди людей, летучих мышей и других млекопитающих без образования значительных резервуаров ни у одного из них до пандемии. [72]

Панголины считаются возможным резервуаром SARS-CoV-2 . [73] Панголины иногда продаются на рынках дикой природы в Китае, где они считаются кулинарным деликатесом и компонентом традиционной медицины. [13] Наибольшее сходство последовательностей с доменом связывания рецептора шипа SARS-CoV-2 было обнаружено у коронавируса, инфицирующего панголинов Сунда в провинции Гуандун . [33] Панголины часто контрабандой ввозятся в Китай. [45] Литрас и др. написали, что, в соответствии с отсутствием зарегистрированных случаев заражения панголинов в Малайзии, они, вероятно, были инфицированы после того, как были ввезены в Китай контрабандой. [45]
Домен связывания рецептора SARS-CoV-2 имеет больше синонимичных замен с панголин-CoV, чем с RaTG13. [74] Однако потенциал связывания SARS-CoV-2 с ACE2 панголина очень низок. [37] Предполагается, что домен связывания рецептора SARS-CoV-2 возник в результате рекомбинации соответствующей части панголин-CoV с вирусом, подобным RaTG13. [75]
Оленьи мыши очень восприимчивы к SARS-CoV-2, что делает их потенциальными резервуарными или промежуточными хозяевами. [76] Енотовидные собаки могут передавать SARS-CoV-2 другим животным в условиях, подобных фермерским. [68] Передача между енотовидными собаками была показана в лабораторных условиях. [65] Белохвостые олени являются потенциальным переносчиком SARS-CoV-2. [68]
Предполагается, что распространение произошло на одном или нескольких рынках дикой природы в Китае. [77] Дикие и полудикие животные обычно продаются и потребляются в Китае, и эта практика расширилась в последние десятилетия. Тесный контакт между животными в антисанитарных условиях создает потенциал для процветания болезней. Во время вспышки в Гуандуне в 2002 году большинство живых животных на рынках показали серологические доказательства воздействия SARS-CoV-1. [70]

Многие ранние случаи были связаны с рынком морепродуктов Хуанань в Ухане. [21] Первое задокументированное заражение COVID-19 произошло у работника прилавка с морепродуктами на рынке Хуанань. [78] Последовательности от этого пациента не были опубликованы; однако, SARS-CoV-2, принадлежащий к линии B/L, был обнаружен в образцах окружающей среды из прилавка пациента. [78] Сообщалось, что в период с мая 2017 года по ноябрь 2019 года на рынке не было ни летучих мышей, ни панголинов. На рынке были енотовидные собаки, которые, как предполагается, восприимчивы к SARS-CoV-2. [79] Исследование, проведенное Хе и соавторами в 2021 году, выявило 102 вируса, поражающих млекопитающих, у китайских промысловых животных, 65 из которых были идентифицированы впервые. [80] Они не обнаружили никаких вирусов, подобных SARS, но нашли доказательства передачи вируса, похожего на MERS, от летучих мышей ежам. [80]
В период с 1 января по 30 марта эпидемиологи из Центра по контролю и профилактике заболеваний Китая собрали 457 образцов из животных, включая туши и фекалии, а также собрали 923 образца из окружающей среды. Все образцы животных дали отрицательный результат на SARS-CoV-2. [81] SARS-CoV-2 был обнаружен в 73 образцах из окружающей среды. Живой вирус был выделен из трех образцов, два из которых были взяты из киосков, принадлежащих известным пациентам. [81] Не было обнаружено значимой связи между титром вируса в окружающей среде и типом продукта, продаваемого в конкретных киосках. [82] SARS-CoV-2 был обнаружен во всех четырех канализационных колодцах на рынке. Надземный дренаж с окружающей территории концентрировался под рынком.
Один образец из окружающей среды содержал линию A/S SARS-CoV-2, в то время как все остальные принадлежали к линии B/L. [83] Образец, содержащий линию A/S, также содержал доказательства присутствия людей и домашнего скота, но не диких животных. [84] В целом, дикие животные, включая енотовидных собак, были обнаружены в очень низких количествах и в основном связаны с отрицательными образцами. [85] Лю и др. написали, что недостаточно информации для определения происхождения вируса. [85] В частности, они написали, что доказательства не доказывают наличие инфицированной енотовидной собаки или возникновение множественных зоонозных перетоков на рынке, как предполагают Пекар и др.
Всемирная организация здравоохранения определяет варианты, вызывающие беспокойство , как варианты с признаками повышенной трансмиссивности, тяжести или ускользания от иммунного контроля. [86] Все варианты, вызывающие беспокойство, до сих пор независимо эволюционировали из исходного штамма, а не друг от друга. [66]
Эволюция варианта Омикрон, по-видимому, была более быстрой, чем у других вариантов. [55] Теории происхождения варианта Омикрон включают долгосрочную циркуляцию среди людей за пределами областей, где проводился генетический надзор, мутацию у человека с ослабленным иммунитетом или адаптацию у видов животных после обратного зооноза. [87] [88] Предполагается, что вариант Омикрон возник у мышей. [41] [88]