Серия актинидов ( / ˈ æ k t ɪ n aɪ d / ) или актиноидов ( / ˈ æ k t ɪ n ɔɪ d / ) включает как минимум 14 металлических химических элементов в серии 5f с атомными номерами от 89 до 102, актиний через нобелий . (Номер 103, лоуренсий , иногда также включается, несмотря на то, что он является частью 6d-переходной серии.) Ряд актинидов получил свое название от первого элемента в ряду, актиния. Неофициальный химический символ An используется в общих обсуждениях химии актинидов для обозначения любого актинида. [1] [2] [3]
Красная книга ИЮПАК 1985 года рекомендует использовать актиноид , а не актинид , поскольку суффикс -ide обычно указывает на отрицательный ион . Однако из-за широкого распространения актинида в настоящее время все еще разрешено. Поскольку актиноид буквально означает актиний-подобный (ср. гуманоид или андроид ), по семантическим причинам утверждалось , что актиний логически не может быть актиноидом, но ИЮПАК признает его включение на основании общего использования. [4]
Все актиниды являются элементами f-блока . Лоренсий иногда также считают таковым, несмотря на то, что он является элементом d-блока [5] [6] и переходным металлом . [7] Серия в основном соответствует заполнению электронной оболочки 5f , хотя многие из изолированных атомов в основном состоянии имеют аномальные конфигурации, связанные с заполнением оболочки 6d из-за межэлектронного отталкивания. По сравнению с лантанидами , также в основном элементами f-блока, актиниды демонстрируют гораздо более переменную валентность . Все они имеют очень большие атомные и ионные радиусы и демонстрируют необычайно широкий диапазон физических свойств. В то время как актиний и поздние актиниды (начиная с кюрия) ведут себя аналогично лантанидам, элементы торий, протактиний и уран по своему химическому составу гораздо больше похожи на переходные металлы , при этом нептуний, плутоний и америций занимают промежуточное положение.
Все актиниды радиоактивны и выделяют энергию при радиоактивном распаде; встречающиеся в природе уран и торий , а также синтетически полученный плутоний являются наиболее распространенными актинидами на Земле. Они использовались в ядерных реакторах , а уран и плутоний являются важнейшими элементами ядерного оружия . Уран и торий также имеют разнообразное нынешнее или историческое применение, а америций используется в ионизационных камерах большинства современных детекторов дыма .
Из актинидов в природе в значительных количествах встречаются первичные торий и уран. Радиоактивный распад урана приводит к образованию временных количеств актиния и протактиния , а атомы нептуния и плутония иногда образуются в результате реакций трансмутации в урановых рудах . Остальные актиниды — чисто синтетические элементы . [1] [8] Испытания ядерного оружия привели к выбросу в окружающую среду по меньшей мере шести актинидов тяжелее плутония ; Анализ обломков взрыва водородной бомбы 1952 года показал наличие америция , кюрия , берклия , калифорния , эйнштейния и фермия . [9]
В представлениях таблицы Менделеева элементы f-блока обычно отображаются в виде двух дополнительных строк под основной частью таблицы. [1] Это соглашение полностью зависит от эстетики и практичности форматирования; в редко используемой широкоформатной таблице Менделеева серии 4f и 5f вставляются на свои места как части шестой и седьмой строк (периодов) таблицы.
Первозданный От распада Синтетический Граница показывает естественное появление элемента
Как и лантаноиды , актиниды образуют семейство элементов со схожими свойствами. Внутри актинидов есть две перекрывающиеся группы: трансурановые элементы , которые следуют за ураном в периодической таблице ; и трансплутониевые элементы , следующие за плутонием. По сравнению с лантанидами, которые (за исключением прометия ) встречаются в природе в заметных количествах, большинство актинидов встречаются редко. Большинство из них не встречаются в природе, а из тех, которые встречаются, только торий и уран встречаются в более чем следовых количествах. Наиболее распространенными или легко синтезируемыми актинидами являются уран и торий, за ними следуют плутоний, америций, актиний, протактиний, нептуний и кюрий. [11]
Существование трансурановых элементов было предположено в 1934 году Энрико Ферми на основе его экспериментов. [12] [13] Однако, хотя к тому времени были известны четыре актинида, еще не было понятно, что они образуют семейство, подобное лантанидам. Преобладающая точка зрения, которая доминировала в ранних исследованиях трансуранов, заключалась в том, что они были обычными элементами 7-го периода, при этом торий, протактиний и уран соответствовали гафнию , танталу и вольфраму 6-го периода соответственно. Синтез трансуранов постепенно подорвал эту точку зрения. К 1944 году наблюдение, что кюрий не проявляет степени окисления выше 4 (в то время как его предполагаемый гомолог 6-го периода, платина , может достигать степени окисления 6), побудило Гленна Сиборга сформулировать « гипотезу актинида ». Исследования известных актинидов и открытие других трансурановых элементов предоставили больше данных в поддержку этой позиции, но фраза «гипотеза актинидов» (подразумевается, что «гипотеза» - это нечто, что не было окончательно доказано) продолжала активно использоваться учеными. до конца 1950-х годов. [14] [15]
В настоящее время существуют два основных метода получения изотопов трансплутониевых элементов: (1) облучение более легких элементов нейтронами ; (2) облучение ускоренными заряженными частицами. Первый метод более важен для приложений, поскольку только нейтронное облучение с использованием ядерных реакторов позволяет производить значительные количества синтетических актинидов; однако он ограничен относительно легкими элементами. Преимущество второго метода состоит в том, что можно получить элементы тяжелее плутония, а также нейтронодефицитные изотопы, не образующиеся при нейтронном облучении. [16]
В 1962–1966 годах в США были попытки получения изотопов трансплутония с помощью серии из шести подземных ядерных взрывов . Небольшие образцы горных пород были извлечены из зоны взрыва сразу после испытания для изучения продуктов взрыва, но изотопов с массовым числом более 257 обнаружить не удалось, несмотря на предсказания, что такие изотопы будут иметь относительно длительный период полураспада α -распада . Это ненаблюдение было приписано спонтанному делению из-за большой скорости продуктов и другим каналам распада, таким как испускание нейтронов и деление ядер . [17]

Уран и торий были первыми открытыми актинидами . Уран был обнаружен в 1789 году немецким химиком Мартином Генрихом Клапротом в урановой руде. Он назвал его в честь планеты Уран , [8] которая была открыта восемью годами ранее. Клапроту удалось осадить желтое соединение (вероятно, диуранат натрия ), растворив настуран в азотной кислоте и нейтрализовав раствор гидроксидом натрия . Затем он восстановил полученный желтый порошок древесным углем и выделил черное вещество, которое принял за металл. [18] Шестьдесят лет спустя французский ученый Эжен-Мельхиор Пелиго идентифицировал его как оксид урана. Он также выделил первый образец металлического урана путем нагревания тетрахлорида урана с металлическим калием . [19] Атомная масса урана тогда была рассчитана как 120, но Дмитрий Менделеев в 1872 году исправил ее до 240, используя свои законы периодичности. Это значение было подтверждено экспериментально в 1882 г. К. Циммерманом. [20] [21]
Оксид тория был открыт Фридрихом Вёлером в минерале торианите , который был найден в Норвегии (1827 г.). [22] Йонс Якоб Берцелиус более подробно охарактеризовал этот материал в 1828 году. Путем восстановления тетрахлорида тория калием он выделил металл и назвал его торием в честь скандинавского бога грома и молнии Тора . [23] [24] Тот же метод изоляции позже был использован Пелиго для урана. [8]
Актиний был открыт в 1899 году Андре-Луи Дебьерном , помощником Марии Кюри , в урановых отходах, оставшихся после удаления радия и полония. Он описал это вещество (в 1899 г.) как подобное титану [25] и (в 1900 г.) как похожее на торий. [26] Однако открытие актиния Дебьерном подвергалось сомнению в 1971 [27] и 2000 годах, [28] утверждая, что публикации Дебьерна в 1904 году противоречили его более ранним работам 1899–1900 годов. Вместо этого эта точка зрения отдает должное работе Фридриха Оскара Гизеля 1902 года , который обнаружил радиоактивный элемент, названный эманием , который вел себя так же, как лантан. Название актиний происходит от древнегреческого : ακτίς, ακτίνος (aktis, aktinos) , что означает луч или луч. Этот металл был открыт не его собственным излучением, а излучением дочерних продуктов. [29] [30] Из-за близкого сходства актиния и лантана и их низкого содержания чистый актиний мог быть получен только в 1950 году. Термин «актинид», вероятно, был введен Виктором Гольдшмидтом в 1937 году . [31] [32]
Протактиний, возможно, был выделен в 1900 году Уильямом Круксом . [33] Впервые он был идентифицирован в 1913 году, когда Казимир Фаянс и Освальд Гельмут Геринг столкнулись с короткоживущим изотопом 234m Па (период полураспада 1,17 минуты) во время изучения распада 238 U. Они назвали новый элемент brevium (от латинского brevis, что означает краткий); [34] [35] название было изменено на протоактиний (от греческого πρῶτος + ἀκτίς, что означает «первый лучевой элемент») в 1918 году, когда две группы ученых во главе с австрийкой Лизой Мейтнер и Отто Ханом из Германии, а также Фредериком Содди и Джоном Крэнстоном из Великобритании независимо открыл гораздо более долгоживущий 231 Па. В 1949 году название было сокращено до протактиния . Этот элемент мало охарактеризовался до 1960 года, когда А. Г. Мэддок и его коллеги в Великобритании выделили 130 граммов протактиния из 60 тонн отходов, остающихся после извлечения урана из руды. [36]
Нептуний (названный в честь планеты Нептун , следующей планеты после Урана, в честь которой был назван уран) был открыт Эдвином Макмилланом и Филипом Х. Абельсоном в 1940 году в Беркли, Калифорния . [37] Они произвели изотоп 239 Np (период полураспада 2,4 дня) путем бомбардировки урана медленными нейтронами . [36] Это был первый трансурановый элемент , полученный синтетически. [38]

Трансурановые элементы не встречаются в больших количествах в природе и обычно синтезируются посредством ядерных реакций , проводимых в ядерных реакторах. Например, при облучении реакторными нейтронами уран-238 частично превращается в плутоний-239 :
Эту реакцию синтеза использовал Ферми и его сотрудники при проектировании реакторов, расположенных на Хэнфордском полигоне , которые производили значительные количества плутония-239 для ядерного оружия Манхэттенского проекта и послевоенного ядерного арсенала США. [39]
Актиниды с наибольшими массовыми числами синтезируются путем бомбардировки урана, плутония, кюрия и калифорния ионами азота, кислорода, углерода, неона или бора в ускорителе частиц . Таким образом, нобелий был получен путем бомбардировки урана-238 неоном-22 в виде
Первые изотопы трансплутониевых элементов, америций-241 и кюрий-242 , были синтезированы в 1944 году Гленном Т. Сиборгом, Ральфом А. Джеймсом и Альбертом Гиорсо . [40] Кюрий-242 был получен бомбардировкой плутония-239 α-частицами с энергией 32 МэВ:
Изотопы америция-241 и кюрия-242 также были получены путем облучения плутония в ядерном реакторе. Последний элемент был назван в честь Марии Кюри и ее мужа Пьера , которые известны открытием радия и своими работами в области радиоактивности . [41]
Бомбардировка кюрия-242 α-частицами привела к образованию изотопа калифорния 245 Cf в 1950 году, а аналогичная процедура позволила получить берклий-243 из америция-241 в 1949 году . [42] Новые элементы были названы в честь Беркли, Калифорния , по аналогии с его гомолог лантаноида тербий , названный в честь деревни Иттерби в Швеции. [43]
В 1945 году Б. Б. Каннингем получил первое массовое химическое соединение трансплутониевого элемента, а именно гидроксид америция . [44] За несколько лет были накоплены миллиграммовые количества америция и микрограммовые количества кюрия, что позволило производить изотопы берклия (Томсон, 1949) [45] [46] и калифорния (Томсон, 1950). [47] [48] [49] Значительные количества этих элементов были произведены в 1958 году (Беррис Б. Каннингем и Стэнли Г. Томсон), [50] а первое калифорниевое соединение (0,3 мкг CfOCl) было получено в 1960 году Б.Б. Каннингем и Дж. К. Уоллманн. [51]
Эйнштейний и фермий были идентифицированы в 1952–1953 годах в осадках ядерного испытания « Айви Майк » (1 ноября 1952 года), первого успешного испытания водородной бомбы. Мгновенное воздействие на уран-238 большого потока нейтронов в результате взрыва привело к образованию тяжелых изотопов урана, включая уран-253 и уран-255, а их β-распад привел к образованию эйнштейния-253 и фермия-255 . Открытие новых элементов и новые данные по захвату нейтронов изначально держались в секрете по приказу военных США до 1955 года из-за напряженности в холодной войне . [9] [52] Тем не менее, команда из Беркли смогла получить эйнштейний и фермий гражданскими методами, посредством нейтронной бомбардировки плутония-239, и опубликовала эту работу в 1954 году с оговоркой, что это были не первые исследования, которые были проведены. осуществляется на этих элементах. [53] [54] Исследования «Айви Майка» были рассекречены и опубликованы в 1955 году. [52] Первые значительные (субмикрограммы) количества эйнштейния были получены в 1961 году Каннингемом и его коллегами, но для фермия это еще не было сделано. [55]
Первый изотоп менделевия, 256 Md (период полураспада 87 минут), был синтезирован Альбертом Гиорсо, Гленном Т. Сиборгом, Грегори Р. Чоппином, Бернардом Г. Харви и Стэнли Г. Томпсоном, когда они бомбардировали мишень из 253 Es альфа- содержанием. частицы в 60-дюймовом циклотроне Радиационной лаборатории Беркли ; это был первый изотоп любого элемента, синтезированный по одному атому за раз. [56]
Было несколько попыток получения изотопов нобелия шведскими (1957) и американскими (1958) группами, но первым достоверным результатом стал синтез 256 No русской группой ( Георгий Флеров и др.) в 1965 г., по признанию ИЮПАК в 1992 г. В своих экспериментах Флёров с соавт. бомбардировали уран-238 неоном-22. [10]
В 1961 году Гиорсо и др. получил первый изотоп лоуренсия путем облучения калифорния (в основном калифорния-252 ) ионами бора-10 и бора-11 . [10] Массовое число этого изотопа в то время точно не было установлено (возможно, 258 или 259). В 1965 г. Флеровым с соавт. был синтезирован 256 Lr . с 243 утра и 18 утра . Таким образом, ИЮПАК признал группы ядерных физиков в Дубне и Беркли соавторами открытия лоуренция.

Известно 33 изотопа актиния и восемь возбужденных изомерных состояний некоторых его нуклидов с массовым числом от 204 до 236. [57] Три изотопа: 225 Ac , 227 Ac и 228 Ac , были обнаружены в природе, а остальные были получены. в лаборатории; в приложениях используются только три природных изотопа. Актиний-225 — представитель радиоактивного ряда нептуния ; [60] он был впервые обнаружен в 1947 году как продукт распада урана-233 и представляет собой α-излучатель с периодом полураспада 10 дней. Актиний-225 менее доступен, чем актиний-228, но более перспективен в качестве радиофармпрепаратов. [30] Актиний-227 (период полураспада 21,77 года) встречается во всех урановых рудах, но в небольших количествах. В одном грамме урана (в радиоактивном равновесии) содержится всего 2 × 10−10 грамм 227 Ак. [30] [57] Актиний-228 является членом радиоактивного ряда тория , образующегося в результате распада 228 Ra ; [60] это β - излучатель с периодом полураспада 6,15 часов. В одной тонне тория содержится 5 × 10−8 грамм 228 Ак. Он был открыт Отто Ханом в 1906 году. [30]
Известно 32 изотопа тория с массовым числом от 207 до 238. [57] Из них самым долгоживущим является 232 Th, период полураспада которого составляет1,4 × 10 10 лет означает, что он все еще существует в природе как первичный нуклид . Следующим по продолжительности жизни является 230 Th, промежуточный продукт распада 238 U с периодом полураспада 75 400 лет. Период полураспада некоторых других изотопов тория превышает сутки; все они также являются переходными в цепочках распада 232 Th, 235 U и 238 U.
Известны 28 изотопов протактиния с массовыми числами 212–239 [57] , а также три возбужденных изомерных состояния . В природе обнаружено только 231 Па и 234 Па . Все изотопы имеют короткое время жизни, за исключением протактиния-231 (период полураспада 32 760 лет). Важнейшими изотопами являются 231 Па и 233 Па , который является промежуточным продуктом при получении урана-233 и является наиболее доступным среди искусственных изотопов протактиния. 233 Па имеет удобный период полураспада и энергию γ-излучения , поэтому использовался в большинстве исследований химии протактиния. Протактиний-233 представляет собой β-излучатель с периодом полураспада 26,97 дней. [57] [61]
Известно 27 изотопов урана с массовыми числами 215–242 (кроме 220). [58] Три из них, 234 U , 235 U и 238 U, присутствуют в природе в заметных количествах. Среди прочих наиболее важным является 233 U, который является конечным продуктом превращения 232 Th при облучении медленными нейтронами. 233 U имеет гораздо более высокий КПД деления низкоэнергетическими (тепловыми) нейтронами по сравнению, например, с 235 U. Большинство исследований по химии урана проводилось на уране-238 из-за его длительного периода полураспада, равного 4,4 × 10 .9 лет. [62]
Существует 25 изотопов нептуния с массовыми числами 219–244 (кроме 221); [58] все они очень радиоактивны. Наибольшую популярность среди ученых имеют долгоживущие 237 Np (t 1/2 = 2,20 × 106 лет) и короткоживущие 239 Нп, 238 Нп (t 1/2 ~ 2 сут). [38]
Известно 20 изотопов плутония с массовыми числами 228–247. [58] Наиболее стабильным изотопом плутония является 244 Pu с периодом полураспада 8,13 × 10.7 лет. [57]
Известно восемнадцать изотопов америция с массовыми числами от 229 до 247 (за исключением 231). [58] Наиболее важными являются 241 Am и 243 Am, которые являются альфа-излучателями и также излучают мягкие, но интенсивные γ-лучи; оба они могут быть получены в изотопно чистой форме. Химические свойства америция сначала изучали с 241 Am, но позже перешли на 243 Am, который почти в 20 раз менее радиоактивен. Недостатком 243 Am является образование короткоживущего дочернего изотопа 239 Np, что необходимо учитывать при анализе данных. [63]
Среди 19 изотопов кюрия с массовым числом от 233 до 251 [58] наиболее доступными являются 242 Cm и 244 Cm; они являются α-излучателями, но с гораздо более коротким временем жизни, чем изотопы америция. Эти изотопы почти не испускают γ-излучения, но подвергаются спонтанному делению с сопутствующим испусканием нейтронов. Более долгоживущие изотопы кюрия ( 245–248 См, все α-излучатели) образуются в виде смеси при нейтронном облучении плутония или америция. При кратковременном облучении в этой смеси преобладает 246 См, а затем начинает накапливаться 248 См. Оба этих изотопа, особенно 248 Cm, имеют более длительный период полураспада (3,48 × 105 лет) и гораздо удобнее для проведения химических исследований, чем 242 См и 244 См, но обладают и достаточно высокой скоростью спонтанного деления. 247 Cm имеет самое продолжительное время жизни среди изотопов кюрия (1,56 × 107 лет), но не образуется в больших количествах из-за сильного деления, индуцированного тепловыми нейтронами.
Идентифицировано семнадцать изотопов берклия с массовыми числами 233–234, 236, 238 и 240–252. [58] Только 249 Bk доступен в больших количествах; он имеет относительно короткий период полураспада — 330 дней и испускает преимущественно мягкие β-частицы , которые неудобны для обнаружения. Его альфа-излучение довольно слабое (1,45 × 10−3 % по отношению к β-излучению), но иногда используется для обнаружения этого изотопа. 247 Bk представляет собой альфа-излучатель с длительным периодом полураспада (1380 лет), но его трудно получить в заметных количествах; он не образуется при нейтронном облучении плутония, поскольку β-распад изотопов кюрия с массовым числом ниже 248 неизвестен. [63] ( 247 Cm на самом деле выделял бы энергию в результате β-распада до 247 Bk, но этого никогда не наблюдалось.)
20 изотопов калифорния с массовыми числами 237–256 образуются в ядерных реакторах; [58] калифорний-253 является β-излучателем, остальные — α-излучателями. Изотопы с четными массовыми числами ( 250 Cf, 252 Cf и 254 Cf) имеют высокую скорость спонтанного деления, особенно 254 Cf, 99,7% которого распадается путем спонтанного деления. Калифорний-249 имеет относительно длительный период полураспада (352 года), слабое спонтанное деление и сильное γ-излучение, что облегчает его идентификацию. 249 Cf не образуется в больших количествах в ядерном реакторе из-за медленного β-распада материнского изотопа 249 Bk и большого сечения взаимодействия с нейтронами, но может накапливаться в изотопно-чистом виде по мере β-распада продукт (предварительно выбранный) 249 Bk. Калифорний, полученный реакторным облучением плутония, состоит в основном из 250 Cf и 252 Cf, причем последний преобладает при больших флюенсах нейтронов, и его исследование затруднено сильным нейтронным излучением. [64]
Среди 18 известных изотопов эйнштейния с массовыми числами от 240 до 257 [58] наиболее доступным является 253 Es. Это α-излучатель с периодом полураспада 20,47 суток, относительно слабым γ-излучением и небольшой скоростью спонтанного деления по сравнению с изотопами калифорния. При длительном нейтронном облучении также образуется долгоживущий изотоп 254 Es (t 1/2 = 275,5 суток). [64]
Известны двадцать изотопов фермия с массовыми числами 241–260. 254 Fm, 255 Fm и 256 Fm представляют собой α-излучатели с коротким периодом полураспада (часы), которые можно выделить в значительных количествах. 257 Фм (t 1/2 = 100 сут) может накапливаться при длительном и сильном облучении. Все эти изотопы характеризуются высокими скоростями спонтанного деления. [64] [66]
Среди 17 известных изотопов менделевия (массовые числа от 244 до 260) [58] наиболее изученным является 256 Md, распадающийся в основном за счет электронного захвата (α-излучение ≈10%) с периодом полураспада 77 минут. . Другой альфа-излучатель, 258 Md, имеет период полураспада 53 дня. Оба этих изотопа производятся из редкого эйнштейния ( 253 Es и 255 Es соответственно), что ограничивает их доступность. [57]
Долгоживущие изотопы нобелия и изотопы лоуренсия (и более тяжелых элементов) имеют относительно короткий период полураспада. Для нобелия известно 13 изотопов с массовыми числами 249–260 и 262. Химические свойства нобелия и лоуренция изучались с 255 No (t 1/2 = 3 мин) и 256 Lr (t 1/2 = 35 с). . Самый долгоживущий изотоп нобелия 259 No имеет период полураспада около 1 часа. [57] Лоуренсий имеет 14 известных изотопов с массовыми числами 251–262, 264 и 266. Наиболее стабильным из них является 266 Lr с периодом полураспада 11 часов.
Среди всех этих изотопов единственными изотопами, которые встречаются в природе в достаточных количествах, чтобы их можно было обнаружить в виде чего-то большего, чем следы, и которые вносят измеримый вклад в атомный вес актинидов, являются первичные 232 Th, 235 U и 238 U, а также три изотопа. долгоживущие продукты распада природного урана — 230 Th, 231 Па и 234 U. Природный торий состоит из 0,02(2)% 230 Th и 99,98(2)% 232 Th; природный протактиний на 100% состоит из 231 Па; а природный уран состоит из 0,0054(5)% 234 U, 0,7204(6)% 235 U и 99,2742(10)% 238 U. [67]
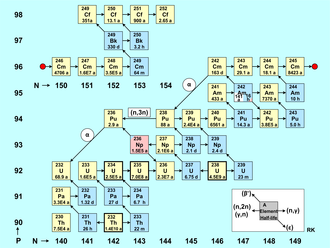
Рисунок построения актинидов представляет собой таблицу нуклидов с числом нейтронов по горизонтальной оси (изотопы) и количеством протонов по вертикальной оси (элементы). Красная точка делит нуклиды на две группы, поэтому рисунок получается более компактным. Каждый нуклид представлен квадратом с массовым числом элемента и периодом его полураспада. [68] Природно существующие изотопы актинидов (Th, U) отмечены жирной рамкой, альфа-излучатели имеют желтый цвет, а бета-излучатели имеют синий цвет. Розовый цвет указывает на захват электрона ( 236 Np), тогда как белый означает длительное метастабильное состояние ( 242 Am).
Для образования актинидных нуклидов характерно прежде всего: [69]
Помимо этих ядерных реакций, вызванных нейтронами или гамма-излучением, радиоактивное преобразование нуклидов актинидов также влияет на количество нуклидов в реакторе. Эти типы распада отмечены на рисунке диагональными стрелками. Бета -минус-распад , отмеченный стрелкой, направленной вверх-влево, играет важную роль для баланса плотностей частиц нуклидов. Нуклиды, распадающиеся за счет эмиссии позитронов (бета-распад) или захвата электронов (ϵ), не встречаются в ядерном реакторе, за исключением продуктов реакций выбивания; их распад отмечен стрелками, направленными вниз-вправо. Из-за больших периодов полураспада данных нуклидов альфа-распад практически не играет роли в образовании и распаде актинидов в энергетическом реакторе, поскольку время пребывания ядерного топлива в активной зоне реактора достаточно мало (несколько лет). ). Исключением являются два относительно короткоживущих нуклида 242 Cm (T 1/2 = 163 d) и 236 Pu (T 1/2 = 2,9 y). Только для этих двух случаев α-распад отмечен на карте нуклидов длинной стрелкой, направленной вниз-влево. Некоторые долгоживущие изотопы актинидов, такие как 244 Pu и 250 Cm, не могут быть произведены в реакторах, поскольку захват нейтронов не происходит достаточно быстро, чтобы обойти короткоживущие бета-распадающиеся нуклиды 243 Pu и 249 Cm; однако они могут генерироваться при ядерных взрывах, которые имеют гораздо более высокие потоки нейтронов.

Торий и уран являются наиболее распространенными актинидами в природе с массовыми концентрациями соответственно 16 ppm и 4 ppm. [70] Уран в основном встречается в земной коре в виде смеси его оксидов в минерале уранините , который также называют настураном из-за его черного цвета. Известно несколько десятков других урановых минералов , таких как карнотит (KUO 2 VO 4 ·3H 2 O) и аутунит (Ca(UO 2 ) 2 (PO 4 ) 2 ·nH 2 O). Изотопный состав природного урана: 238 U (относительное содержание 99,2742%), 235 U (0,7204%) и 234 U (0,0054%); из них 238 U имеет наибольший период полураспада 4,51 × 109 лет. [71] [72] Мировое производство урана в 2009 году составило 50 572 тонны , из которых 27,3% было добыто в Казахстане . Другими важными странами по добыче урана являются Канада (20,1%), Австралия (15,7%), Намибия (9,1%), Россия (7,0%) и Нигер (6,4%). [73]
Наиболее распространенными минералами тория являются торианит ( ThO 2 ), торит ( ThSiO 4 ) и монацит ( (Th,Ca,Ce)PO 4 ). Большинство минералов тория содержат уран и наоборот; и все они содержат значительную долю лантаноидов. Богатые месторождения минералов тория расположены в США (440 000 тонн), Австралии и Индии (~300 000 тонн каждая) и Канаде (~100 000 тонн). [75]
Распространенность актиния в земной коре составляет всего около 5 × 10−15 %. [61] Актиний в основном присутствует в урансодержащих, но также и в других минералах, хотя и в гораздо меньших количествах. Содержание актиния в большинстве природных объектов соответствует изотопному равновесию родительского изотопа 235 U и на него не влияет слабая Ас-миграция. [30] Протактиний более распространен (10-12 % ) в земной коре, чем актиний. Он был обнаружен в урановой руде в 1913 году Фаянсом и Герингом. [34] Как и актиний, распределение протактиния соответствует распределению 235 U. [61]
Период полураспада самого долгоживущего изотопа нептуния 237 Np ничтожно мал по сравнению с возрастом Земли. Таким образом, нептуний присутствует в природе в незначительных количествах и образуется как промежуточные продукты распада других изотопов. [38] Следы плутония в урановых минералах были впервые обнаружены в 1942 году, а более систематические результаты по 239 Pu сведены в таблицу (никаких других изотопов плутония в этих образцах обнаружить не удалось). Верхний предел содержания самого долгоживущего изотопа плутония 244 Pu составляет 3 × 10−20 %. Плутоний не удалось обнаружить в образцах лунного грунта. Из-за его редкости в природе большая часть плутония производится синтетически. [74]

Из-за малой распространенности актинидов их экстракция представляет собой сложный многостадийный процесс. Обычно используются фториды актинидов, поскольку они нерастворимы в воде и легко отделяются окислительно-восстановительными реакциями. Фториды восстанавливаются кальцием , магнием или барием : [76]
Среди актинидов легче всего выделить торий и уран. Торий извлекают главным образом из монацита : пирофосфат тория (ThP 2 O 7 ) реагируют с азотной кислотой и полученный нитрат тория обрабатывают трибутилфосфатом . Редкоземельные примеси отделяются повышением рН сульфатного раствора. [76]
В другом методе экстракции монацит разлагается 45%-ным водным раствором гидроксида натрия при температуре 140 °С. Смешанные гидроксиды металлов сначала экстрагируют, фильтруют при 80°С, промывают водой и растворяют концентрированной соляной кислотой . Далее кислый раствор нейтрализуют гидроксидами до рН = 5,8, в результате чего выпадает гидроксид тория (Th(OH) 4 ), загрязненный ~3% гидроксидов редкоземельных элементов; остальная часть гидроксидов редкоземельных элементов остается в растворе. Гидроксид тория растворяют в неорганической кислоте, а затем очищают от редкоземельных элементов . Эффективным методом является растворение гидроксида тория в азотной кислоте, поскольку полученный раствор можно очистить экстракцией органическими растворителями: [76]

Металлический торий отделяют от безводного оксида, хлорида или фторида путем его взаимодействия с кальцием в инертной атмосфере: [78]
Иногда торий выделяют электролизом фторида в смеси хлоридов натрия и калия при температуре 700–800 °С в графитовом тигле. Высокочистый торий можно извлечь из его йодида с помощью процесса кристаллического слитка . [79]
Уран добывают из руд различными способами. В одном методе руда сжигается, а затем подвергается реакции с азотной кислотой для перевода урана в растворенное состояние. Обработка раствора раствором трибутилфосфата (ТБФ) в керосине переводит уран в органическую форму UO 2 (NO 3 ) 2 (ТБФ) 2 . Нерастворимые примеси фильтруют, а уран экстрагируют реакцией с гидроксидами в виде (NH 4 ) 2 U 2 O 7 или с перекисью водорода в виде UO 4 ·2H 2 O. [76]
Когда урановая руда богата такими минералами, как доломит , магнезит и т. д., эти минералы потребляют много кислоты. В этом случае для извлечения урана используется карбонатный метод. Его основным компонентом является водный раствор карбоната натрия , который превращает уран в комплекс [UO 2 (CO 3 ) 3 ] 4- , устойчивый в водных растворах при низких концентрациях гидроксид-ионов. Преимущества метода карбоната натрия заключаются в том, что химические вещества обладают низкой коррозионной активностью (по сравнению с нитратами) и что большинство неурановых металлов выпадает в осадок из раствора. Недостатком является то, что также выпадают в осадок соединения четырехвалентного урана. Поэтому урановую руду обрабатывают карбонатом натрия при повышенной температуре и давлении кислорода:
Это уравнение предполагает, что лучшим растворителем для переработки карбоната урана является смесь карбоната с бикарбонатом. При высоком pH это приводит к осаждению диураната, который при обработке водородом в присутствии никеля дает нерастворимый тетракарбонат урана. [76]
Другой метод разделения использует полимерные смолы в качестве полиэлектролита . Ионообменные процессы в смолах приводят к выделению урана. Уран из смол промывают раствором аммиачной селитры или азотной кислоты, что дает уранилнитрат UO 2 (NO 3 ) 2 ·6H 2 O. При нагревании он превращается в UO 3 , который с водородом превращается в UO 2 :
Реакция диоксида урана с плавиковой кислотой превращает его в тетрафторид урана , который дает металлический уран при реакции с металлическим магнием: [78]
Для извлечения плутония облученный нейтронами уран растворяют в азотной кислоте и к полученному раствору добавляют восстановитель ( FeSO 4 , или H 2 O 2 ). Это присоединение меняет степень окисления плутония с +6 на +4, при этом уран остается в виде нитрата уранила (UO 2 (NO 3 ) 2 ). Раствор обрабатывают восстановителем и нейтрализуют карбонатом аммония до pH = 8, что приводит к осаждению соединений Pu 4+ . [76]
В другом методе Pu 4+ и UO2+
2сначала экстрагируются трибутилфосфатом, затем реагируют с гидразином, вымывая извлеченный плутоний. [76]
Основная трудность разделения актиния заключается в сходстве его свойств со свойствами лантана. Таким образом, актиний либо синтезируется в ядерных реакциях из изотопов радия, либо выделяется с помощью ионообменных процедур. [30]
Актиниды имеют свойства, аналогичные лантанидам. Так же, как электронные оболочки 4f заполнены в лантаноидах, электронные оболочки 5f заполнены в актинидах. Поскольку оболочки 5f, 6d, 7s и 7p близки по энергии, возникает множество неправильных конфигураций; таким образом, в атомах газовой фазы, как первый 4f-электрон появляется только в церии, так первый 5f-электрон появляется еще позже, в протактинии. Однако так же, как лантан является первым элементом, использующим в соединениях оболочку 4f, [80] так и актиний является первым элементом, использующим в соединениях оболочку 5f. [81] F-оболочки завершают свое заполнение вместе на иттербии и нобелии. [82] Первые экспериментальные доказательства заполнения 5f-оболочки у актинидов были получены Макмилланом и Абельсоном в 1940 году. [83] Как и в лантаноидах (см. сокращение лантаноидов ), ионный радиус актинидов монотонно уменьшается с ростом атомного номера (см. также принцип Ауфбау ). [84]
Сдвиг электронных конфигураций в газовой фазе не всегда соответствует химическому поведению. Например, высшая степень окисления, подобная ранним переходным металлам, соответствующая удалению всех валентных электронов, распространяется вплоть до урана, хотя оболочки 5f начинают заполняться раньше этого. С другой стороны, электронные конфигурации, напоминающие конгенеры лантаноидов, уже начинаются с плутония, хотя лантаноидное поведение не становится доминирующим до тех пор, пока вторая половина ряда не начинается с кюрия. Элементы между ураном и кюрием образуют переход между этими двумя типами поведения, при которых более высокие степени окисления продолжают существовать, но теряют стабильность по отношению к состоянию +3. [82] Состояние +2 становится более важным ближе к концу ряда и является наиболее стабильной степенью окисления нобелия, последнего 5f-элемента. [82] Степени окисления снова повышаются только после нобелия, показывая, что началась новая серия 6d-переходных металлов: лоуренсий показывает только степень окисления +3, а резерфордий - только +4, что делает их родственниками лютеция и гафния в 5d. ряд. [82]

Актиниды — типичные металлы. Все они мягкие, имеют серебристый цвет (но тускнеют на воздухе), [90] сравнительно высокую плотность и пластичность. Некоторые из них можно разрезать ножом. Их электрическое сопротивление варьируется от 15 до 150 мкОм·см. [85] Твердость тория аналогична твердости мягкой стали, поэтому нагретый чистый торий можно свернуть в листы и натянуть на проволоку. Торий почти вдвое менее плотен, чем уран и плутоний, но тверже любого из них. Все актиниды радиоактивны, парамагнитны и, за исключением актиния, имеют несколько кристаллических фаз: у плутония их семь, а урана, нептуния и калифорния — три. Кристаллические структуры протактиния, урана, нептуния и плутония не имеют явных аналогов среди лантаноидов и больше похожи на структуры 3d - переходных металлов . [72]
Все актиниды пирофорны , особенно в мелкодисперсном виде, то есть самопроизвольно воспламеняются при реакции с воздухом при комнатной температуре. [90] [91] Температура плавления актинидов не имеет четкой зависимости от числа f -электронов. Необычайно низкая температура плавления нептуния и плутония (~ 640 °С) объясняется гибридизацией 5f- и 6d - орбиталей и образованием направленных связей в этих металлах. [72]
Как и лантаноиды, все актиниды обладают высокой реакционной способностью по отношению к галогенам и халькогенам ; однако актиниды реагируют легче. Актиниды, особенно с небольшим числом 5f - электронов, склонны к гибридизации . Это объясняется подобием энергий электронов на 5 f , 7 s и 6 d оболочках. Большинство актинидов демонстрируют большее разнообразие валентных состояний, наиболее стабильными являются +6 для урана, +5 для протактиния и нептуния, +4 для тория и плутония и +3 для актиния и других актинидов. [93]
Актиний химически подобен лантану, что объясняется их схожими ионными радиусами и электронным строением. Как и лантан, актиний почти всегда имеет в соединениях степень окисления +3, но он менее реакционноспособен и обладает более выраженными основными свойствами. Среди других трехвалентных актинидов Ас 3+ наименее кислый, т.е. имеет самую слабую склонность к гидролизу в водных растворах. [30] [72]
Торий весьма активен химически. Из-за отсутствия электронов на 6 d- и 5 f -орбиталях соединения четырехвалентного тория бесцветны. При pH < 3 в растворах солей тория преобладают катионы [Th(H 2 O) 8 ] 4+ . Ион Th 4+ относительно велик и в зависимости от координационного числа может иметь радиус от 0,95 до 1,14 Å. В результате соли тория имеют слабую склонность к гидролизу. Отличительной способностью солей тория является их высокая растворимость как в воде, так и в полярных органических растворителях. [72]
Протактиний демонстрирует два валентных состояния; состояние +5 стабильно, а состояние +4 легко окисляется до протактиния (V). Так, четырехвалентный протактиний в растворах получается действием сильных восстановителей в атмосфере водорода. Четырехвалентный протактиний химически подобен урану (IV) и торию (IV). Фториды, фосфаты, гипофосфат, йодат и фениларсонаты протактиния(IV) нерастворимы в воде и разбавленных кислотах. Протактиний образует растворимые карбонаты. Гидролитические свойства пятивалентного протактиния близки к танталу (V) и ниобию (V). Сложное химическое поведение протактиния является следствием начала заполнения 5f- оболочки этого элемента. [61]
У урана валентность от 3 до 6, причем последняя наиболее стабильна. В шестивалентном состоянии уран очень похож на элементы 6 группы . Многие соединения урана(IV) и урана(VI) нестехиометричны , т. е. имеют переменный состав. Например, фактическая химическая формула диоксида урана — UO 2+x , где x варьируется от –0,4 до 0,32. Соединения урана(VI) являются слабыми окислителями . Большинство из них содержат линейную « уранильную » группу UO .2+
2. От 4 до 6 лигандов могут быть размещены в экваториальной плоскости, перпендикулярной уранильной группе. Уранильная группа действует как жесткая кислота и образует более прочные комплексы с лигандами-донорами кислорода, чем с лигандами-донорами азота. НпО2+
2и ПуО2+
2также являются распространенной формой Np и Pu в степени окисления +6. Соединения урана(IV) обладают восстановительными свойствами, например, легко окисляются кислородом воздуха. Уран(III) – очень сильный восстановитель. Благодаря наличию d-оболочки уран (как и многие другие актиниды) образует металлоорганические соединения , такие как U III (C 5 H 5 ) 3 и U IV (C 5 H 5 ) 4 . [72] [94]
Нептуний имеет валентные состояния от 3 до 7, которые одновременно можно наблюдать в растворах. Наиболее стабильное состояние в растворе +5, но в твердых соединениях нептуния предпочтительна валентность +4. Металлический нептуний очень реакционноспособен. Ионы нептуния склонны к гидролизу и образованию координационных соединений . [38]
Плутоний также имеет валентные состояния от 3 до 7 включительно и, таким образом, химически подобен нептунию и урану. Он обладает высокой реакционной способностью и быстро образует оксидную пленку на воздухе. Плутоний реагирует с водородом даже при температуре 25–50 ° C; он также легко образует галогениды и интерметаллические соединения . Реакции гидролиза ионов плутония разных степеней окисления весьма разнообразны. Плутоний(V) может вступать в реакции полимеризации . [95] [96]
Наибольшее химическое разнообразие среди актинидов наблюдается у америция, валентность которого может иметь от 2 до 6. Двухвалентный америций получается только в сухих соединениях и неводных растворах ( ацетонитрил ). Степени окисления +3, +5 и +6 типичны для водных растворов, но также и в твердом состоянии. Четырехвалентный америций образует устойчивые твердые соединения (диоксид, фторид и гидроксид), а также комплексы в водных растворах. Сообщалось, что в щелочном растворе америций может окисляться до семивалентного состояния, но эти данные оказались ошибочными. Наиболее устойчивая валентность америция равна 3 в водных растворах и 3 или 4 в твердых соединениях. [97]
Валентность 3 преобладает у всех последующих элементов вплоть до лоуренция (за исключением нобелия). Кюрий может быть четырехвалентным в твердых телах (фторид, диоксид). Берклий, наряду с валентностью +3, проявляет и валентность +4, более стабильную, чем у кюрия; валентность 4 наблюдается в твердых фториде и диоксиде. Стабильность Bk 4+ в водном растворе близка к стабильности Ce 4+ . [98] Только валентность 3 наблюдалась для калифорния, эйнштейния и фермия. Двухвалентное состояние доказано для менделевия и нобелия, причем у нобелия оно более устойчиво, чем трехвалентное состояние. Лоуренсий проявляет валентность 3 как в растворах, так и в твердых веществах. [97]
Окислительно-восстановительный потенциал увеличивается от -0,32 В в уране до 0,34 В (Np) и 1,04 В (Pu) до 1,34 В в америции, что свидетельствует о возрастающей восстановительной способности иона An 4+ от америция до урана. Все актиниды образуют гидриды AnH 3 черного цвета с солеподобными свойствами. Актиниды также производят карбиды с общей формулой AnC или AnC 2 (U 2 C 3 для урана), а также сульфиды An 2 S 3 и AnS 2 . [93]
Некоторые актиниды могут существовать в нескольких оксидных формах, таких как An 2 O 3 , AnO 2 , An 2 O 5 и AnO 3 . Для всех актинидов оксиды AnO 3 амфотерны , а An 2 O 3 , AnO 2 и An 2 O 5 являются основными , легко реагируют с водой, образуя основания: [93]
Эти основания плохо растворимы в воде и по активности близки к гидроксидам редкоземельных металлов. [93] Np(OH) 3 пока не синтезирован, Pu(OH) 3 имеет синий цвет, Am(OH) 3 — розовый, а гидроксид кюрия Cm(OH) 3 — бесцветен. [105] Bk(OH) 3 и Cf(OH) 3 также известны, а также четырехвалентные гидроксиды для Np, Pu и Am и пятивалентные для Np и Am. [105]
Самое сильное основание – актиний. Все соединения актиния бесцветны, кроме черного сульфида актиния (Ac 2 S 3 ). [93] Диоксиды четырехвалентных актинидов кристаллизуются в кубической системе , так же, как и во фториде кальция .
Торий, реагируя с кислородом, образует исключительно диоксид:
Диоксид тория — тугоплавкий материал с самой высокой температурой плавления среди всех известных оксидов (3390 °C). [103] Добавление 0,8–1% ThO 2 к вольфраму стабилизирует его структуру, поэтому легированные нити обладают лучшей механической устойчивостью к вибрациям. Для растворения ThO 2 в кислотах его нагревают до 500–600 °С; при нагревании выше 600 °C образуется очень устойчивая к кислотам и другим реагентам форма ThO 2 . Небольшая добавка ионов фтора катализирует растворение диоксида тория в кислотах.
Получены два оксида протактиния: PaO 2 (черный) и Pa 2 O 5 (белый); первый изоморфен ThO 2 , а второй легче получить. Оба оксида являются основными, а Pa(OH) 5 — слабым, плохо растворимым основанием. [93]
Разложение некоторых солей урана, например UO 2 (NO 3 )·6H 2 O, на воздухе при 400 °С дает оранжевый или желтый UO 3 . [103] Этот оксид амфотерен и образует несколько гидроксидов, наиболее стабильным из которых является гидроксид уранила UO 2 (OH) 2 . В результате реакции оксида урана(VI) с водородом образуется диоксид урана, близкий по своим свойствам с ThO 2 . Этот оксид также является основным и соответствует гидроксиду урана (U(OH) 4 ). [93]
Плутоний, нептуний и америций образуют два основных оксида: An 2 O 3 и AnO 2 . Триоксид нептуния нестабилен; таким образом, пока удалось получить только Np 3 O 8 . Однако хорошо охарактеризованы оксиды плутония и нептуния с химической формулой AnO 2 и An 2 O 3 . [93]

Актиниды легко реагируют с галогенами, образуя соли с формулами MX 3 и MX 4 (X = галоген ). Так первое соединение берклия BkCl 3 было синтезировано в 1962 году в количестве 3 нанограммов. Подобно галогенам редкоземельных элементов, хлориды , бромиды и йодиды актинидов растворимы в воде, а фториды — нерастворимы. Уран легко дает бесцветный гексафторид, который сублимируется при температуре 56,5°С; из-за своей летучести его используют при разделении изотопов урана с помощью газовой центрифуги или газовой диффузии . Гексафториды актинидов по свойствам близки к ангидридам . Они очень чувствительны к влаге и гидролизуются, образуя AnO 2 F 2 . [109] Были синтезированы пентахлорид и черный гексахлорид урана, но они оба нестабильны. [93]
При действии кислот на актиниды образуются соли, причем если кислоты неокисляющие, то актинид в соли находится в низковалентном состоянии:
Однако в этих реакциях регенерирующий водород может вступать в реакцию с металлом, образуя соответствующий гидрид. Уран гораздо легче реагирует с кислотами и водой, чем торий. [93]
Соли актинидов можно получить также растворением соответствующих гидроксидов в кислотах. Нитраты, хлориды, сульфаты и перхлораты актинидов растворимы в воде. При кристаллизации из водных растворов эти соли образуют гидраты, такие как Th(NO 3 ) 4 ·6H 2 O, Th(SO 4 ) 2 ·9H 2 O и Pu 2 (SO 4 ) 3 ·7H 2 O. Соли высоковалентные актиниды легко гидролизуются. Так, бесцветные сульфат, хлорид, перхлорат и нитрат тория превращаются в основные соли с формулами Th(OH) 2 SO 4 и Th(OH) 3 NO 3 . Растворимость и нерастворимость трехвалентных и четырехвалентных актинидов аналогичны растворимости солей лантаноидов. Так фосфаты , фториды , оксалаты , йодаты и карбонаты актинидов слабо растворимы в воде; они осаждаются в виде гидратов, таких как ThF 4 ·3H 2 O и Th(CrO 4 ) 2 ·3H 2 O. [93]
Актиниды со степенью окисления +6, за исключением катионов типа AnO 2 2+ , образуют [AnO 4 ] 2- , [An 2 O 7 ] 2- и другие комплексные анионы. Например, уран, нептуний и плутоний образуют соли типа Na 2 UO 4 (уранат) и (NH 4 ) 2 U 2 O 7 (диуранат). По сравнению с лантанидами актиниды легче образуют координационные соединения , причем эта способность возрастает с увеличением валентности актинида. Трехвалентные актиниды не образуют фторидных координационных соединений, тогда как четырехвалентный торий образует комплексы K 2 ThF 6 , KThF 5 и даже K 5 ThF 9 . Торий также образует соответствующие сульфаты (например Na 2 SO 4 ·Th(SO 4 ) 2 ·5H 2 O), нитраты и родацианаты. Соли общей формулы An 2 Th(NO 3 ) 6 · n H 2 O имеют координационную природу, с координационным числом тория, равным 12. Еще проще получить сложные соли пятивалентных и шестивалентных актинидов. Наиболее устойчивые координационные соединения актинидов — четырехвалентные торий и уран — получаются в реакциях с дикетонами, например с ацетилацетоном . [93]

Хотя актиниды имеют широкое применение в повседневной жизни, например, в детекторах дыма (америций) [110] [111] и газовых мантиях (торий), [78] они в основном используются в ядерном оружии и в качестве топлива в ядерных реакторах. [78] Последние две области используют свойство актинидов выделять огромную энергию в ядерных реакциях, которые при определенных условиях могут стать самоподдерживающимися цепными реакциями .

Наиболее важным изотопом для ядерной энергетики является уран-235 . Он используется в тепловом реакторе , а его концентрация в природном уране не превышает 0,72%. Этот изотоп сильно поглощает тепловые нейтроны, выделяя много энергии. Один акт деления 1 грамма 235 U превращается в мощность около 1 МВт·сут. Важно то, что235
92ты
излучает больше нейтронов, чем поглощает; [112] при достижении критической массы ,235
92ты
вступает в самоподдерживающуюся цепную реакцию. [72] Обычно ядро урана делится на два фрагмента с выделением 2–3 нейтронов, например:
Другими многообещающими изотопами актинидов для ядерной энергетики являются торий-232 и его продукт ториевого топливного цикла , уран-233 .
Эмиссия нейтронов при делении урана важна не только для поддержания цепной ядерной реакции, но и для синтеза более тяжелых актинидов. Уран-239 посредством β-распада превращается в плутоний-239, который, как и уран-235, способен к спонтанному делению. Первые в мире ядерные реакторы были построены не для получения энергии, а для производства плутония-239 для ядерного оружия.
Около половины производимого тория используется в качестве светоизлучающего материала газовых мантий. [ 78] Торий также добавляется в многокомпонентные сплавы магния и цинка . Так, сплавы Mg-Th легкие и прочные, но при этом обладают высокой температурой плавления и пластичностью и поэтому широко используются в авиационной промышленности и при производстве ракет . Торий также обладает хорошими свойствами эмиссии электронов , имеет длительный срок службы и низкий потенциальный барьер для эмиссии. [112] Относительное содержание изотопов тория и урана широко используется для оценки возраста различных объектов, в том числе звезд (см. радиометрическое датирование ). [115]
Основное применение плутоний нашел в ядерном оружии , где изотоп плутоний-239 был ключевым компонентом из-за его легкости деления и доступности. Конструкции на основе плутония позволяют снизить критическую массу примерно до трети от критической массы урана-235. [116] В плутониевых бомбах типа «Толстяк», произведенных в ходе Манхэттенского проекта , использовалось взрывное сжатие плутония для получения значительно более высоких плотностей, чем обычно, в сочетании с центральным источником нейтронов для начала реакции и повышения эффективности. Таким образом, для взрывной мощности , эквивалентной 20 килотоннам в тротиловом эквиваленте , потребовалось всего 6,2 кг плутония . [117] (См. также «Проектирование ядерного оружия» .) Гипотетически всего лишь 4 кг плутония — а может быть, и меньше — можно было бы использовать для изготовления одной атомной бомбы с использованием очень сложной конструкции сборки. [118]
Плутоний-238 потенциально является более эффективным изотопом для ядерных реакторов, поскольку он имеет меньшую критическую массу, чем уран-235, но продолжает выделять много тепловой энергии (0,56 Вт/г) [111] [119] при распаде, даже когда цепь деления Реакция останавливается стержнями управления. Его применение ограничено высокой ценой (около 1000 долларов США/г). Этот изотоп использовался в термобатареях и системах дистилляции воды некоторых космических спутников и станций. Так, космические корабли «Галилео» и «Аполлон» (например, «Аполлон-14» [120] ) имели нагреватели, питаемые килограммами оксида плутония-238; это тепло также преобразуется в электричество с помощью термобатарей. Распад плутония-238 дает относительно безвредные альфа-частицы и не сопровождается гамма-облучением. Поэтому этот изотоп (~160 мг) используется в качестве источника энергии в кардиостимуляторах, где его срок службы примерно в 5 раз дольше, чем у обычных батарей. [111]
Актиний-227 используется в качестве источника нейтронов. Его высокая удельная энергия (14,5 Вт/г) и возможность получения значительных количеств термостабильных соединений привлекательны для использования в долговечных термоэлектрических генераторах дистанционного применения. 228 Ac используется в качестве индикатора радиоактивности в химических исследованиях, поскольку он испускает электроны высокой энергии (2,18 МэВ), которые можно легко обнаружить. Смеси 228 Ac - 228 Ra широко используются в качестве интенсивного гамма-источника в промышленности и медицине. [30]
Разработка самосветящихся материалов, легированных актинидами, с прочной кристаллической матрицей является новым направлением использования актинидов, поскольку добавление альфа-излучающих радионуклидов к некоторым стеклам и кристаллам может придавать люминесценцию. [121]
Радиоактивные вещества могут нанести вред здоровью человека через (i) местное загрязнение кожи, (ii) внутреннее облучение в результате попадания в организм радиоактивных изотопов и (iii) внешнее чрезмерное облучение в результате β-активности и γ-излучения . Вместе с радием и трансурановыми элементами актиний является одним из наиболее опасных радиоактивных ядов с высокой удельной α-активностью . Важнейшей особенностью актиния является его способность накапливаться и сохраняться в поверхностном слое скелетов . На начальной стадии отравления актиний накапливается в печени . Другая опасность актиния состоит в том, что он подвергается радиоактивному распаду быстрее, чем выводится из организма. Адсорбция актиния из пищеварительного тракта значительно меньше (~0,05%), чем радия. [30]
Протактиний в организме имеет тенденцию накапливаться в почках и костях. Максимальная безопасная доза протактиния в организме человека составляет 0,03 мкКи , что соответствует 0,5 мкг 231 Па. Этот изотоп, который может присутствовать в воздухе в виде аэрозоля , составляет 2,5 × 10В 8 раз токсичнее синильной кислоты . [61] [ противоречиво ]
Плутоний, попадая в организм через воздух, пищу или кровь (например, через рану), в основном оседает в легких, печени и костях, и лишь около 10% попадает в другие органы и остается там десятилетиями. Длительное время пребывания плутония в организме отчасти объясняется его плохой растворимостью в воде. Некоторые изотопы плутония испускают ионизирующее α-излучение, повреждающее окружающие клетки. Средняя смертельная доза (ЛД 50 ) за 30 дней у собак после внутривенного введения плутония составляет 0,32 миллиграмма на кг массы тела, таким образом, смертельная доза для человека составляет примерно 22 мг для человека массой 70 кг; количество респираторного воздействия должно быть примерно в четыре раза больше. Другая оценка предполагает, что плутоний в 50 раз менее токсичен, чем радий , и поэтому допустимое содержание плутония в организме должно составлять 5 мкг или 0,3 мкКи. Такое количество практически незаметно под микроскопом. После испытаний на животных эта предельно допустимая доза была снижена до 0,65 мкг или 0,04 мкКи. Исследования на животных также показали, что наиболее опасным путем воздействия плутония является ингаляционный, при котором в организме сохраняется 5–25% вдыхаемых веществ. В зависимости от размера частиц и растворимости соединений плутония плутоний локализуется либо в легких, либо в лимфатической системе , либо всасывается в кровь и затем транспортируется в печень и кости. Заражение через пищу – наименее вероятный путь. При этом в кровь всасывается лишь около 0,05% растворимых и 0,01% нерастворимых соединений плутония, а остальная часть выводится из организма. Воздействие плутония на поврежденную кожу сохранит почти 100% его содержания. [95]
Использование актинидов в ядерном топливе, закрытых радиоактивных источниках или современных материалах, таких как самосветящиеся кристаллы, имеет множество потенциальных преимуществ. Однако серьезную озабоченность вызывает чрезвычайно высокая радиотоксичность актинидов и их миграция в окружающую среду. [122] Использование химически нестабильных форм актинидов в МОХ-топливе и закрытых радиоактивных источниках не соответствует современным стандартам безопасности. Существует задача разработки стабильных и долговечных материалов, содержащих актиниды, которые обеспечивали бы безопасное хранение, использование и окончательную утилизацию. Ключевой потребностью является применение твердых растворов актинидов в прочных кристаллических фазах-хозяевах. [121]
{{cite book}}: |journal=игнорируется ( помощь )Многие актиниды металлов, гидриды, карбиды, сплавы и другие соединения могут воспламеняться при комнатной температуре в мелкодисперсном состоянии.