В химии химическая реакция называется автокаталитической, если один из продуктов реакции также является катализатором для той же реакции. [1] Известны многие формы автокатализа. [2] [3]
Набор химических реакций можно назвать «совместно автокаталитическим», если некоторые из этих реакций производят в качестве продуктов реакции катализаторы для достаточного количества других реакций, так что весь набор химических реакций становится самоподдерживающимся при наличии энергии и молекул пищи (см. автокаталитический набор ).
Катализируемый кислотой гидролиз сложных эфиров производит карбоновые кислоты, которые также катализируют ту же реакцию. Действительно, наблюдение за ускоряющимся гидролизом гамма-валеролактона в гамма-гидроксивалериановую кислоту привело к введению концепции автокатализа в 1890 году. [4]
Окисление углеводородов воздухом или кислородом является основой автоокисления . Как и во многих радикальных реакциях, график зависимости скорости от времени имеет сигмоидальное поведение, характерное для автокатализа. [5] Многие реакции органических соединений с галогеном включают автокаталитические радикальные механизмы . Например, реакция ацетофенона с бромом с образованием фенацилбромида .
Колебательные реакции, такие как реакция Белоусова-Жаботинского, являются более сложными примерами, включающими автокатализ. [2] В таких реакциях концентрации некоторых промежуточных продуктов колеблются, как и скорость образования продуктов. Другими примечательными примерами являются уравнения Лотки-Вольтерры для модели хищник-жертва и модель Брюсселятора .
Автокатализ также применим к реакциям с участием твердых веществ. Рост кристаллов дает яркие примеры автокатализа: скорость роста зависит от площади поверхности растущего кристалла. Рост металлических пленок из раствора с использованием техники химического осаждения является автокаталитическим. Скорость осаждения ускоряется после того, как произошло некоторое осаждение, т. е. зародышеобразование . [6]

Автокаталитические реакции — это те, в которых хотя бы один из продуктов также является реагентом. Простая автокаталитическая реакция может быть записана [3]
с уравнениями скорости (для элементарной реакции)
Это реакция, в которой молекула вида A взаимодействует с молекулой вида B. Молекула A превращается в молекулу B. Конечный продукт состоит из исходной молекулы B и молекулы B, созданной в ходе реакции.
Ключевой особенностью этих уравнений скорости является то, что они нелинейны ; второй член справа изменяется как квадрат концентрации B. Эта особенность может привести к нескольким фиксированным точкам системы, подобно тому, как квадратное уравнение может иметь два корня. Несколько фиксированных точек допускают несколько состояний системы. Система, существующая в нескольких макроскопических состояниях, более упорядочена (имеет более низкую энтропию), чем система в одном состоянии.
Концентрации А и В изменяются со временем в соответствии с
и
Для необратимой реакции (т.е. ) [3] [7]
и
График для этих уравнений представляет собой сигмоидальную кривую (в частности, логистическую функцию ), что типично для автокаталитических реакций: эти химические реакции протекают медленно в начале ( период индукции ), поскольку присутствует мало катализатора, скорость реакции постепенно увеличивается по мере протекания реакции, поскольку количество катализатора увеличивается, а затем она снова замедляется по мере уменьшения концентрации реагента. Если концентрация реагента или продукта в эксперименте следует сигмоидальной кривой, реакция может быть автокаталитической.
Эти кинетические уравнения применяются, например, к кислотно-катализируемому гидролизу некоторых эфиров до карбоновых кислот и спиртов . [7] Для запуска каталитического механизма изначально должно присутствовать по крайней мере немного кислоты; в противном случае реакция должна начаться по альтернативному некатализируемому пути, который обычно медленнее. Приведенные выше уравнения (которые не рассматривают альтернативный путь) для каталитического механизма подразумевали бы, что концентрация кислотного продукта остается нулевой навсегда. [7]
Асимметричный автокатализ происходит, когда продукт реакции является хиральным и, таким образом, служит катализатором для своего собственного производства. Реакции этого типа, такие как реакция Соаи , обладают свойством, что они могут усиливать очень малый энантиомерный избыток в большой. [8] В другом примере хлорат натрия кристаллизуется как равновесная смесь лево- и правосторонних кристаллов. При затравке соответствующих насыщенных растворов этой соли (которая оптически неактивна) будут производить партии отдельных энантиомерных кристаллов. [9]
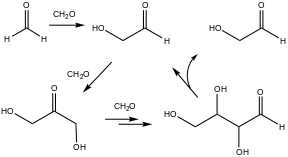
Ранним примером автокатализа является реакция формозы , в которой формальдегид и основание производят сахара и связанные с ними полиолы. Характерная для автокатализа скорость этой реакции изначально крайне медленная, но со временем ускоряется. Этот тип реакции часто упоминается как имеющий отношение к происхождению жизни. [2]
Автокатализ является одним из объяснений абиогенеза . [10] [11] [12] Показательной является реакция аминоаденозина и пентафторфенилового эфира в присутствии аминоаденозинтрикислотного эфира (AATE). Этот эксперимент продемонстрировал, что автокатализаторы могут проявлять конкуренцию в популяции сущностей с наследственностью, что можно интерпретировать как рудиментарную форму естественного отбора , и что определенные изменения окружающей среды (например, облучение) могут изменять химическую структуру некоторых из этих самовоспроизводящихся молекул (аналог мутации) таким образом, что это может либо усиливать, либо препятствовать их способности реагировать, тем самым усиливая или препятствуя их способности реплицироваться и распространяться в популяции. [13]