
Правило октета — это химическое эмпирическое правило , которое отражает теорию о том, что элементы главной группы имеют тенденцию связываться таким образом, что каждый атом имеет восемь электронов в своей валентной оболочке , что дает ему ту же электронную конфигурацию , что и благородный газ . Правило особенно применимо к углероду , азоту , кислороду и галогенам ; хотя в более общем смысле правило применимо к s-блоку и p-блоку периодической таблицы . Существуют и другие правила для других элементов, такие как правило дуплета для водорода и гелия и правило 18 электронов для переходных металлов .
Валентные электроны можно подсчитать с помощью электронной точечной диаграммы Льюиса , как показано справа для углекислого газа. Электроны, общие для двух атомов в ковалентной связи , подсчитываются дважды, по одному для каждого атома. В углекислом газе каждый кислород делит четыре электрона с центральным углеродом, два (показаны красным) от самого кислорода и два (показаны черным) от углерода. Все четыре из этих электронов подсчитываются как в октете углерода, так и в октете кислорода, так что оба атома считаются подчиняющимися правилу октета.
Ионная связь распространена между парами атомов, где один из пары является металлом с низкой электроотрицательностью (например, натрием ), а второй — неметаллом с высокой электроотрицательностью (например, хлором ).
Атом хлора имеет семь электронов в третьей и внешней электронной оболочке, первая и вторая оболочки заполнены двумя и восемью электронами соответственно. Первое электронное сродство хлора (энергия, выделяемая при присоединении хлором электрона для образования Cl − ) составляет 349 кДж на моль атомов хлора. [1] Добавление второго электрона для образования гипотетического Cl 2- потребовало бы энергии, энергии, которая не может быть восстановлена путем образования химической связи. В результате хлор очень часто образует соединение, в котором он имеет восемь электронов во внешней оболочке (полный октет), как в Cl − .
Атом натрия имеет один электрон в своей внешней электронной оболочке, первая и вторая оболочки снова заполнены двумя и восемью электронами соответственно. Для удаления этого внешнего электрона требуется только первая энергия ионизации , которая составляет +495,8 кДж на моль атомов натрия, небольшое количество энергии. Напротив, второй электрон находится в более глубокой второй электронной оболочке, и вторая энергия ионизации, необходимая для его удаления, намного больше: +4562 кДж на моль. [2] Таким образом, натрий в большинстве случаев образует соединение, в котором он потерял один электрон и имеет полную внешнюю оболочку из восьми электронов, или октет.
Энергия, необходимая для переноса электрона от атома натрия к атому хлора (разница первой энергии ионизации натрия и электронного сродства хлора), мала: +495,8 − 349 = +147 кДж моль −1 . Эта энергия легко компенсируется энергией решетки хлорида натрия : −783 кДж моль −1 . [3] Это завершает объяснение правила октета в данном случае.

В 1864 году английский химик Джон Ньюлендс классифицировал шестьдесят два известных элемента на восемь групп на основе их физических свойств. [4] [5] [6] [7]
В конце 19 века было известно, что координационные соединения (ранее называвшиеся «молекулярными соединениями») образуются путем объединения атомов или молекул таким образом, что валентности вовлеченных атомов, по-видимому, становятся удовлетворенными. В 1893 году Альфред Вернер показал, что число атомов или групп, связанных с центральным атомом (« координационное число »), часто равно 4 или 6; были известны и другие координационные числа вплоть до максимального значения 8, но они встречались реже. [8] В 1904 году Ричард Абегг был одним из первых, кто расширил концепцию координационного числа до концепции валентности , в которой он различал атомы как доноры или акцепторы электронов, что привело к положительным и отрицательным валентным состояниям, которые очень напоминают современную концепцию степеней окисления . Абегг отметил , что разница между максимальной положительной и отрицательной валентностью элемента в его модели часто составляет восемь. [9] В 1916 году Гилберт Н. Льюис назвал это понимание правилом Абегга и использовал его для формулировки своей кубической модели атома и «правила восьми», которое начало различать валентные и валентные электроны . [10] В 1919 году Ирвинг Ленгмюр усовершенствовал эти концепции и переименовал их в «кубический октетный атом» и «теорию октета». [11] «Теория октета» превратилась в то, что сейчас известно как «правило октета».
Вальтер Коссель [12] и Гилберт Н. Льюис увидели, что благородные газы не имеют тенденции принимать участие в химических реакциях в обычных условиях. На основе этого наблюдения они пришли к выводу, что атомы благородных газов стабильны, и на основе этого вывода в 1916 году предложили теорию валентности , известную как «электронная теория валентности»:
В процессе образования химической связи атомы объединяются, приобретая, теряя или делясь электронами таким образом, что они приобретают ближайшую конфигурацию благородного газа. [13]
Квантовая теория атома объясняет восемь электронов как замкнутую оболочку с электронной конфигурацией s 2 p 6. Замкнутая конфигурация оболочки — это та, в которой низколежащие энергетические уровни заполнены, а более высокие энергетические уровни пусты. Например, основное состояние атома неона имеет заполненную оболочку n = 2 (2s 2 2p 6 ) и пустую оболочку n = 3. Согласно правилу октета, атомы, расположенные непосредственно до и после неона в периодической таблице (т. е. C, N, O, F, Na, Mg и Al), имеют тенденцию достигать аналогичной конфигурации, приобретая, теряя или делясь электронами.
Атом аргона имеет аналогичную конфигурацию 3s 2 3p 6. Также имеется пустой 3d-уровень, но он находится на значительно более высокой энергии, чем 3s и 3p (в отличие от атома водорода), так что 3s 2 3p 6 все еще считается закрытой оболочкой для химических целей. Атомы, расположенные непосредственно перед и после аргона, имеют тенденцию достигать этой конфигурации в соединениях. Однако существуют некоторые гипервалентные молекулы , в которых 3d-уровень может играть роль в связывании, хотя это спорно (см. ниже).
Для гелия нет уровня 1p согласно квантовой теории, так что 1s 2 представляет собой замкнутую оболочку без p-электронов. Атомы до и после гелия (H и Li) следуют правилу дуэта и, как правило, имеют ту же конфигурацию 1s 2 , что и гелий.
Многие реактивные промежуточные соединения нестабильны и не подчиняются правилу октета. К ним относятся такие виды, как карбены , а также свободные радикалы и метильный радикал (CH 3 ), который имеет неспаренный электрон на несвязывающей орбитали на атоме углерода и не имеет электрона противоположного спина на той же орбитали. Другим примером является радикал оксид хлора (ClO • ), который участвует в истощении озонового слоя . Эти молекулы часто реагируют таким образом, чтобы завершить свой октет. Молекулы с дефицитом электронов , такие как бораны, также не подчиняются правилу октета, но делят делокализованные электроны способом, похожим на металлическую связь .
Хотя обычно считается, что стабильные молекулы с нечетными электронами и гипервалентные молекулы нарушают правило октета, расчеты молекулярных орбиталей ab initio показывают, что они в значительной степени подчиняются правилу октета (см. разделы о трехэлектронных связях и гипервалентных молекулах ниже).

Некоторые стабильные молекулярные радикалы (например, оксид азота , NO) получают конфигурации октета с помощью трехэлектронной связи , которая вносит один общий и один неподеленный электрон в октет каждого связанного атома. [14] В NO октет на каждом атоме состоит из двух электронов из трехэлектронной связи, плюс четыре электрона из двух двухэлектронных связей и два электрона из неподеленной пары несвязывающих электронов только на этом атоме. Порядок связи равен 2,5, поскольку каждая двухэлектронная связь считается одной связью, в то время как трехэлектронная связь имеет только один общий электрон и, следовательно, соответствует полусвязи.
Дикислород иногда представляется как подчиняющийся правилу октета с двойной связью (O=O), содержащей две пары общих электронов. [15] Однако основное состояние этой молекулы является парамагнитным , что указывает на наличие неспаренных электронов. Полинг предположил, что эта молекула на самом деле содержит две трехэлектронные связи и одну нормальную ковалентную (двухэлектронную) связь. [16] Тогда октет на каждом атоме состоит из двух электронов от каждой трехэлектронной связи, плюс два электрона ковалентной связи, плюс одна неподеленная пара несвязывающих электронов. Порядок связи составляет 1+0,5+0,5=2.
Элементы главной группы в третьей и последующих строках периодической таблицы могут образовывать гиперкоординированные или гипервалентные молекулы , в которых центральный атом главной группы связан с более чем четырьмя другими атомами, например, пентафторид фосфора , PF 5 , и гексафторид серы , SF 6 . Например, в PF 5 , если предположить, что существует пять истинных ковалентных связей , в которых совместно используются пять различных электронных пар, то фосфор будет окружен 10 валентными электронами, что нарушает правило октета. На заре квантовой механики Полинг предположил, что атомы третьего ряда могут образовывать пять связей, используя одну s, три p и одну d орбитали, или шесть связей, используя одну s, три p и две d орбитали. [17] Для образования пяти связей одна s, три p и одна d орбитали объединяются, образуя пять sp 3 d гибридных орбиталей , каждая из которых делит электронную пару с атомом галогена, в общей сложности 10 общих электронов, на два больше, чем предсказывает правило октета. Аналогично для образования шести связей шесть sp 3 d 2 гибридных орбиталей образуют шесть связей с 12 общими электронами. [18] В этой модели наличие пустых d орбиталей используется для объяснения того факта, что атомы третьего ряда, такие как фосфор и сера, могут образовывать более четырех ковалентных связей, тогда как атомы второго ряда, такие как азот и кислород, строго ограничены правилом октета. [19]
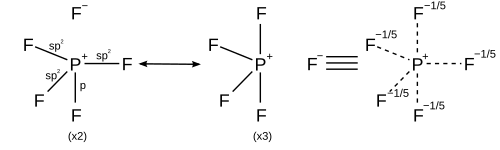
Однако другие модели описывают связь, используя только s- и p-орбитали в соответствии с правилом октета. Описание валентной связи PF 5 использует резонанс между различными структурами PF 4 + F − , так что каждый F связан ковалентной связью в четырех структурах и ионной связью в одной структуре. Каждая резонансная структура имеет восемь валентных электронов на P. [20] Описание теории молекулярных орбиталей рассматривает наивысшую занятую молекулярную орбиталь как несвязывающую орбиталь, локализованную на пяти атомах фтора, в дополнение к четырем занятым связывающим орбиталям, так что снова на фосфоре имеется только восемь валентных электронов. [ необходима цитата ] Справедливость правила октета для гипервалентных молекул дополнительно подтверждается расчетами молекулярных орбиталей ab initio , которые показывают, что вклад d-функций в связывающие орбитали мал. [21] [22]
Тем не менее, по историческим причинам структуры, подразумевающие более восьми электронов вокруг таких элементов, как P, S, Se или I, по-прежнему распространены в учебниках и исследовательских статьях. Несмотря на незначительность расширения d-оболочки в химической связи, эта практика позволяет показывать структуры без использования большого количества формальных зарядов или использования частичных связей и рекомендуется ИЮПАК как удобный формализм в предпочтении к изображениям, которые лучше отражают связь. С другой стороны, показ более восьми электронов вокруг Be, B, C, N, O или F (или более двух вокруг H, He или Li) считается ошибкой большинством авторитетов.
Правило октета применимо только к элементам основной группы . Другие элементы следуют другим правилам подсчета электронов , поскольку их конфигурации валентных электронов отличаются от конфигураций элементов основной группы. Эти другие правила показаны ниже:
Источник дает изменение энтальпии -349 кДж, что соответствует выделению энергии +349 кДж.
{{cite book}}: |first2=имеет общее название ( помощь )CS1 maint: multiple names: authors list (link)