Импедансная кардиография (ИКГ) — это неинвазивная технология измерения общей электропроводности грудной клетки и ее изменений во времени для непрерывной обработки ряда кардиодинамических параметров, таких как ударный объем (УО), частота сердечных сокращений (ЧСС), сердечный выброс (СВ). ), время выброса желудочка (VET), период перед выбросом и используется для обнаружения изменений импеданса , вызванных высокочастотным током низкой величины, протекающим через грудную клетку между двумя дополнительными парами электродов, расположенными за пределами измеряемого сегмента. Чувствительные электроды также обнаруживают сигнал ЭКГ, который используется в качестве таймера системы. [1] [2]
Импедансная кардиография (ИКГ), также называемая электроимпедансной плетизмографией (ЭИП) или торакальным электрическим биоимпедансом (ТЕБ), исследуется с 1940-х годов. НАСА помогло разработать эту технологию в 1960-х годах. [3] [4] Начало использованию импедансной кардиографии в психофизиологических исследованиях положила публикация статьи Миллера и Хорвата в 1978 году. [5] Впоследствии рекомендации Миллера и Хорвата были подтверждены группой по стандартизации в 1990 году. [ 6] Полный список литературы доступен в публикациях ICG. При использовании ИКГ четыре двойных одноразовых датчика на шее и груди используются для передачи и обнаружения электрических и импедансных изменений в грудной клетке, которые используются для измерения и расчета кардиодинамических параметров. [ нужна цитата ]
Гемодинамика — это раздел физиологии сердечно-сосудистой системы, который занимается силами, создаваемыми сердцем и возникающими в результате движением крови через сердечно-сосудистую систему. [7] Эти силы демонстрируются клиницисту как парные значения кровотока и артериального давления , измеренные одновременно в выходном узле левого сердца. Гемодинамика — это жидкостный аналог закона Ома в электронике: давление эквивалентно напряжению, поток — току, сопротивление сосудов — электрическому сопротивлению, а работа миокарда — мощности.

Зависимость между мгновенными значениями аортального артериального давления и кровотока через аортальный клапан за один интервал сокращений сердца и их средними значениями изображена на рис.1. Их мгновенные значения могут быть использованы в исследованиях; в клинической практике их средние значения MAP и SV являются адекватными. [ нужна цитата ]
Системными (общими) параметрами кровотока являются (а) скорость кровотока на одно сокращение сердца, ударный объем, SV [мл/удар] и (b) скорость кровотока в минуту, сердечный выброс, CO [л/мин]. Существует четкая связь между этими параметрами кровотока:
CO [л/мин] = (SV [мл] × ЧСС [уд/мин] )/1000 {уравнение 1}где ЧСС — частота пульса (ударов в минуту, ударов в минуту).
Поскольку нормальное значение CO пропорционально массе тела, которое оно должно перфузировать, единого «нормального» значения SV и CO для всех взрослых не может существовать. Все параметры кровотока должны быть проиндексированы. Принятым соглашением является их индексация по площади поверхности тела , BSA [м 2 ], по формуле Дюбуа и Дюбуа, которая является функцией роста и веса:
BSA [м 2 ] = Ш 0,425 [кг] × В 0,725 [см] × 0,007184 {Уравнение 2}Результирующими индексированными параметрами являются индекс инсульта, SI (мл/уд/м 2 ), определяемый как
SI [мл/уд/м 2 ] = SV [мл] /BSA [м 2 ] {уравнение 3}и сердечный индекс, CI (л/мин/м 2 ), определяемый как
CI [л/мин/м 2 ] = CO [л/мин] /BSA [м 2 ] {уравнение 4}Эти индексированные параметры кровотока имеют типичные диапазоны :
Для индекса инсульта: 35 < SI типично < 65 мл/уд/м 2 ; для сердечного индекса: 2,8 < CI типично < 4,2 л/мин/м 2 .
Уравнение 1 для индексированных параметров затем изменится на
CI [л/мин/м 2 ] = (SI [мл/уд/м 2 ] × ЧСС [уд/мин] )/1000 {уравнение 1a}Основная функция сердечно-сосудистой системы — транспорт кислорода: кровь — транспортное средство, кислород — груз. Задача здоровой сердечно-сосудистой системы — обеспечить адекватную перфузию всех органов и поддерживать динамическое равновесие между потребностью в кислороде и доставкой кислорода. У здорового человека сердечно-сосудистая система всегда увеличивает кровоток в ответ на повышенную потребность в кислороде. У человека с гемодинамическими нарушениями, когда система не может удовлетворить повышенную потребность в кислороде, приток крови к органам, находящимся ниже в списке приоритетов доставки кислорода, снижается, и эти органы могут в конечном итоге выйти из строя. Расстройства пищеварения, мужская импотенция, усталость, лунатизм, непереносимость температуры окружающей среды — классические примеры состояния пониженного кровотока, приводящего к снижению кровотока. [ нужна цитата ]
Вариабельность SI и вариабельность MAP осуществляются за счет активности гемодинамических модуляторов .

Традиционными терминами сердечно-сосудистой физиологии для модуляторов гемодинамики являются преднагрузка, сократимость и постнагрузка . Они имеют дело с (а) инерционными силами наполнения крови, возвращающейся в предсердие ( преднагрузка ), которые растягивают волокна миокарда, сохраняя таким образом в них энергию, (б) силой, с помощью которой волокна сердечной мышцы укорачиваются, высвобождая энергию, запасенную в их, чтобы вытеснить часть крови из желудочка в сосудистую систему ( сократимость ), и (в) силы, которые насос должен преодолеть, чтобы доставить болюс крови в аорту при каждом сокращении ( постнагрузка ). Уровень преднагрузки в настоящее время оценивается либо по PAOP (давление окклюзии легочной артерии) у катетеризированного пациента, либо по EDI (конечно-диастолический индекс) с помощью ультразвука. Сократимость обычно не оценивается; нередко инотропию и сократимость путают как равные понятия. Постнагрузка оценивается по значению SVRI.
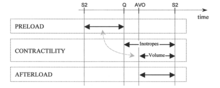
Вместо использования терминов «преднагрузка», «сократимость» и «постнагрузка» предпочтительной терминологией и методологией в посистемной гемодинамике является использование терминов для обозначения реальных инструментов модуляции гемодинамики, которые либо использует организм, либо врач имеет в своем наборе инструментов для контроля гемодинамического состояния:
Преднагрузка и (механически) индуцированный Франком-Старлингом уровень сократимости модулируются изменением внутрисосудистого объема (увеличение объема или уменьшение объема /диурез).
Фармакологическую модуляцию сократимости осуществляют кардиоактивными инотропными агентами (положительными или отрицательными инотропами), присутствующими в кровотоке и влияющими на скорость сокращения волокон миокарда.
Постнагрузка модулируется путем изменения калибра сфинктеров на входе и выходе каждого органа, а, следовательно, и сосудистого сопротивления , с помощью вазоактивных фармакологических агентов (вазоконстрикторов или вазодилататоров и/или ингибиторов АПФ и/или БРА) (АПФ = ангиотензинпревращающий - фермент; БРА = блокатор рецепторов ангиотензина). Постнагрузка также увеличивается с увеличением вязкости крови , однако, за исключением пациентов с крайне гемодилютивной или гемоконцентрированной кровью, этот параметр рутинно не учитывается в клинической практике.
За исключением увеличения объема, которое может быть достигнуто только физическими средствами (внутривенное или пероральное введение жидкости), все остальные средства, модулирующие гемодинамику, являются фармакологическими, кардиоактивными или вазоактивными средствами.
Измерение КИ и его производных позволяет клиницистам своевременно оценивать состояние пациента, ставить диагноз, прогноз и принимать решения о лечении. Хорошо известно, что как обученные, так и неподготовленные врачи не могут оценить сердечный выброс только с помощью физического обследования.
Клинические измерения сердечного выброса доступны с 1970-х годов. Однако это измерение кровотока является высокоинвазивным и использует направленный по потоку термодилюционный катетер (также известный как катетер Свана-Ганца), что представляет значительный риск для пациента. Кроме того, этот метод является дорогостоящим (несколько сотен долларов за процедуру) и требует квалифицированного врача и стерильной среды для введения катетера. В результате он использовался только у очень узкой группы (менее 2%) пациентов в критическом состоянии и пациентов из группы высокого риска, у которых знания о кровотоке и транспорте кислорода перевешивали риски метода. По оценкам, в Соединенных Штатах ежегодно проводится не менее двух миллионов процедур мониторинга катетера легочной артерии, чаще всего у пациентов после операции на сердце и сосудах, при декомпенсированной сердечной недостаточности, полиорганной недостаточности и травмах. [ нужна цитата ]
Теоретически неинвазивный способ мониторинга гемодинамики будет иметь исключительную клиническую ценность, поскольку данные, аналогичные инвазивным методам мониторинга гемодинамики, можно будет получить с гораздо меньшими затратами и без риска. Хотя неинвазивный гемодинамический мониторинг можно использовать у пациентов, которым ранее требовалась инвазивная процедура, наибольший эффект может быть оказан пациентам и учреждениям ухода, где инвазивный гемодинамический мониторинг был невозможен, не стоил риска или затрат. Благодаря безопасности и низкой стоимости применимость витальных гемодинамических измерений может быть расширена для значительно большего числа пациентов, включая амбулаторных пациентов с хроническими заболеваниями. ICG даже использовался в экстремальных условиях, таких как космическое пространство и экспедиция на Эверест. [8] Сердечная недостаточность, гипертония, кардиостимулятор и одышка — это четыре состояния, при которых амбулаторный неинвазивный гемодинамический мониторинг может играть важную роль в оценке, диагностике, прогнозе и лечении. Некоторые исследования показали, что сердечный выброс ICG является точным, [9] [10], тогда как другие исследования показали, что он неточный. [11] Было показано, что использование ICG улучшает контроль артериального давления при резистентной гипертензии при использовании как специалистами [12] , так и врачами общей практики. [13] Было также показано, что ICG предсказывает ухудшение состояния при сердечной недостаточности. [14]
Электрические сигналы и сигналы импеданса обрабатываются для определения контрольных точек, которые затем используются для измерения и расчета гемодинамических параметров, таких как сердечный выброс, ударный объем, системное сосудистое сопротивление, содержание жидкости в грудной клетке, индекс ускорения и соотношение систолического времени.