


Гибридизация in situ (ISH) — это тип гибридизации , при котором используется маркированная комплементарная ДНК , РНК или модифицированная цепь нуклеиновой кислоты (т. е. зонд ) для локализации определенной последовательности ДНК или РНК в части или секции ткани ( in situ ) или, если ткань достаточно мала (например, семена растений, эмбрионы дрозофилы ), во всей ткани (ISH в целом), в клетках и в циркулирующих опухолевых клетках (CTC). Это отличается от иммуногистохимии , которая обычно локализует белки в секциях тканей.
Гибридизация in situ используется для выявления местоположения определенных последовательностей нуклеиновых кислот на хромосомах или в тканях, что является важным шагом для понимания организации, регуляции и функции генов. Основные методы, используемые в настоящее время, включают гибридизацию in situ с мРНК с олигонуклеотидными и РНК-зондами (как радиоактивно мечеными, так и мечеными гаптеном), анализ с помощью световых и электронных микроскопов, гибридизацию in situ всего препарата , двойное обнаружение РНК и РНК плюс белок, а также флуоресцентную гибридизацию in situ для обнаружения хромосомных последовательностей. ДНК ISH может использоваться для определения структуры хромосом. Флуоресцентная ДНК ISH (FISH) может, например, использоваться в медицинской диагностике для оценки целостности хромосом. РНК ISH (гибридизация РНК in situ ) используется для измерения и локализации РНК (мРНК, днРНК и миРНК) в срезах тканей, клетках, тотальных препаратах и циркулирующих опухолевых клетках (ЦОК). Гибридизация in situ была изобретена американскими биологами Мэри-Лу Пардью и Джозефом Г. Галлом . [1] [2] [3]
Гибридизация in situ является мощным методом идентификации конкретных видов мРНК в отдельных клетках в срезах тканей, что позволяет лучше понять физиологические процессы и патогенез заболеваний. Однако гибридизация in situ требует выполнения множества шагов с точной оптимизацией для каждой исследуемой ткани и для каждого используемого зонда. Для сохранения целевой мРНК в тканях часто требуется использование сшивающих фиксаторов (например, формальдегида ). [4]
Кроме того, гибридизация in situ на срезах тканей требует, чтобы срезы тканей были очень тонкими, обычно толщиной от 3 мкм до 7 мкм. Обычные методы подготовки срезов тканей для обработки гибридизацией in situ включают нарезку образцов с помощью криостата или слайсера для тканей Compresstome . Криостат берет свежую или фиксированную ткань и погружает ее в жидкий азот для мгновенной заморозки. Затем ткань помещают в среду для замораживания, называемую OCT, и нарезают тонкие срезы. Препятствия включают получение артефактов замораживания на ткани, которые могут помешать правильному окрашиванию мРНК. Compresstome разрезает ткань на тонкие срезы без процесса замораживания; свободно плавающие срезы нарезаются после помещения в агарозу для стабильности. Этот метод позволяет избежать замораживания ткани и, следовательно, связанных с ним артефактов замораживания. Процесс является постоянным и необратимым после его завершения. [5]
Для гибридизационной гистохимии образцы клеток и тканей обычно обрабатываются для фиксации целевых транскриптов на месте и для увеличения доступа зонда. Как отмечалось выше, зонд представляет собой либо меченую комплементарную ДНК , либо, что сейчас чаще всего, комплементарную РНК ( рибозонд ). Зонд гибридизуется с целевой последовательностью при повышенной температуре, а затем избыток зонда смывается (после предварительного гидролиза с использованием РНКазы в случае негибридизованного избыточного зонда РНК). Параметры раствора, такие как температура, соль и/или концентрация детергента, можно изменять для удаления любых неидентичных взаимодействий (т. е. останутся связанными только точные совпадения последовательностей). Затем зонд, который был мечен либо радио-, флуоресцентно-, либо антиген-мечеными основаниями (например, дигоксигенином ), локализуется и количественно определяется в ткани с использованием либо авторадиографии , либо флуоресцентной микроскопии , либо иммуногистохимии соответственно. ISH также может использовать два или более зонда, помеченных радиоактивностью или другими нерадиоактивными метками, для одновременного обнаружения двух или более транскриптов.
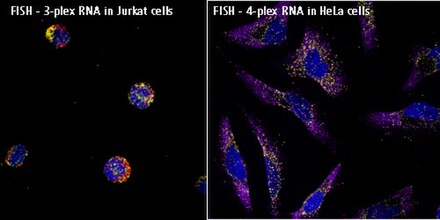
Альтернативная технология, анализ разветвленной ДНК , может использоваться для анализов гибридизации РНК (мРНК, днРНК и мкРНК) in situ с чувствительностью к одной молекуле без использования радиоактивности. Этот подход (например, анализы ViewRNA) может использоваться для визуализации до четырех мишеней в одном анализе, и он использует запатентованную конструкцию зонда и усиление сигнала bDNA для генерации чувствительных и специфических сигналов. Образцы (клетки, ткани и CTC) фиксируются, затем обрабатываются для обеспечения доступности РНК-мишени (демаскировка РНК). Специфичные для мишени зонды гибридизуются с каждой целевой РНК. Последующее усиление сигнала основано на специфической гибридизации соседних зондов (отдельных олигонуклеотидов [oligos], которые связываются бок о бок с РНК-мишенями). Типичный специфичный для мишени зонд будет содержать 40 олигонуклеотидов, что приводит к 20 олигопарам, которые связываются бок о бок с мишенью для обнаружения мРНК и днРНК, и 2 олиго или одной паре для обнаружения мкРНК. Усиление сигнала достигается с помощью серии последовательных шагов гибридизации. Молекула предварительного усилителя гибридизуется с каждой парой олигонуклеотидов на целевой РНК, затем несколько молекул усилителя гибридизуются с каждым предварительным усилителем. Затем несколько олигонуклеотидов зонда-метки (конъюгированных с щелочной фосфатазой или напрямую с флуорофорами) гибридизуются с каждой молекулой усилителя. Полностью собранная структура усиления сигнала «Дерево» имеет 400 участков связывания для зондов-меток. Когда все зонды-метки связываются с целевой транскриптом мРНК, происходит 8000-кратное усиление сигнала для этого одного транскрипта. Отдельные, но совместимые системы усиления сигнала позволяют проводить мультиплексные анализы. Сигнал можно визуализировать с помощью флуоресцентного или светлопольного микроскопа.
Протокол занимает около 2–3 дней и требует некоторого времени для настройки. Некоторые компании продают роботов для автоматизации процесса (например, CEM InsituPro). В результате в лабораториях были проведены крупномасштабные скрининги тысяч генов. Результаты обычно можно получить через веб-сайты (см. внешние ссылки). [6]