Лактозный оперон ( lac оперон) — это оперон, необходимый для транспорта и метаболизма лактозы в E. coli и многих других энтеробактериях . Хотя глюкоза является предпочтительным источником углерода для большинства энтеробактерий, lac оперон позволяет эффективно переваривать лактозу, когда глюкоза недоступна, посредством активности β-галактозидазы . [1] Генная регуляция lac оперона была первым генетическим регуляторным механизмом, который был ясно понят, поэтому она стала выдающимся примером прокариотической регуляции генов . По этой причине ее часто обсуждают на вводных занятиях по молекулярной и клеточной биологии . Эта система метаболизма лактозы использовалась Франсуа Жакобом и Жаком Моно , чтобы определить, как биологическая клетка узнает, какой фермент синтезировать. Их работа над lac опероном принесла им Нобелевскую премию по физиологии в 1965 году. [1]
Большинство бактериальных клеток, включая E. coli, не имеют интронов в своем геноме. У них также отсутствует ядерная мембрана . Следовательно, регуляция генов lac- опероном происходит на уровне транскрипции, предотвращая преобразование ДНК в мРНК .
Бактериальные опероны представляют собой полицистронные транскрипты , способные производить несколько белков из одного транскрипта мРНК . В этом случае, когда в качестве источника сахара для бактерии требуется лактоза, могут быть экспрессированы три гена lac- оперона и транслированы их последующие белки: lacZ , lacY и lacA . Продуктом гена lacZ является β-галактозидаза , которая расщепляет лактозу, дисахарид , на глюкозу и галактозу . lacY кодирует β-галактозидпермеазу , мембранный белок , который встраивается в плазматическую мембрану, обеспечивая клеточный транспорт лактозы в клетку. Наконец, lacA кодирует β-галактозидтрансацетилазу .

Обратите внимание, что число пар оснований на диаграмме, приведенной выше, не для масштаба. На самом деле в lac- опероне более 5300 пар оснований. [2]
Было бы расточительно производить ферменты, когда лактоза недоступна или если доступен предпочтительный источник энергии, такой как глюкоза. Оперон lac использует двухкомпонентный механизм управления, чтобы гарантировать, что клетка тратит энергию на производство ферментов, кодируемых опероном lac, только когда это необходимо. [3]
При отсутствии лактозы lac- репрессор , кодируемый lacI, останавливает выработку ферментов и транспортных белков, кодируемых lac- опероном. [4] Он делает это, блокируя ДНК-зависимую РНК-полимеразу . Эта блокировка/остановка не идеальна, и минимальное количество экспрессии генов происходит все время. Белок-репрессор всегда экспрессируется, но lac- оперон (т. е. ферменты и транспортные белки) почти полностью подавляется, что позволяет иметь небольшой уровень фоновой экспрессии. Если бы это было не так, в клеточной мембране не было бы белка-транспортера lacY; следовательно, lac- оперон не смог бы обнаружить присутствие лактозы.
Когда доступна лактоза, но не глюкоза, то часть лактозы проникает в клетку, используя уже существующий транспортный белок, кодируемый lacY. Затем эта лактоза соединяется с репрессором и инактивирует его, тем самым позволяя экспрессироваться оперону lac . Затем синтезируется больше β-галактозидпермеазы, что позволяет проникнуть еще большему количеству лактозы, и ферменты, кодируемые lacZ и lacA, могут ее переварить.
Однако в присутствии глюкозы, независимо от присутствия лактозы, оперон будет подавлен. Это происходит потому, что белок-активатор катаболита (CAP), необходимый для производства ферментов, остается неактивным, а EIIA Glc отключает пермеазу лактозы, чтобы предотвратить транспорт лактозы в клетку. Этот двойной механизм контроля вызывает последовательное использование глюкозы и лактозы в двух различных фазах роста, известных как диаукси .

По-видимому, для катаболического пути лактозы необходимы только lacZ и lacY .
В цифрах lacI имеет 1100 пар оснований, lacZ имеет 3000 пар оснований, lacY имеет 800 пар оснований, lacA имеет 800 пар оснований, причем 3 пары оснований соответствуют 1 аминокислоте. [5]
Для описания фенотипов бактерий, включая E. coli , используются трехбуквенные аббревиатуры .
Вот несколько примеров:
В случае Lac клетки дикого типа являются Lac + и способны использовать лактозу в качестве источника углерода и энергии, в то время как производные мутанта Lac − не могут использовать лактозу. Те же три буквы обычно используются (строчные, курсивом) для обозначения генов, участвующих в определенном фенотипе, где каждый отдельный ген дополнительно отличается дополнительной буквой. Гены lac, кодирующие ферменты, — lacZ , lacY и lacA . Четвертый ген lac — lacI , кодирующий репрессор лактозы — «I» означает индуцибельность .
Можно различать структурные гены, кодирующие ферменты, и регуляторные гены, кодирующие белки, которые влияют на экспрессию генов. Текущее использование расширяет фенотипическую номенклатуру для применения к белкам: таким образом, LacZ является белковым продуктом гена lacZ , β-галактозидазы. Различные короткие последовательности, которые не являются генами, также влияют на экспрессию генов, включая lac -промотор, lac p , и lac- оператор, lac o . Хотя это не строго стандартное использование, мутации, влияющие на lac o , называются lac o c , по историческим причинам.
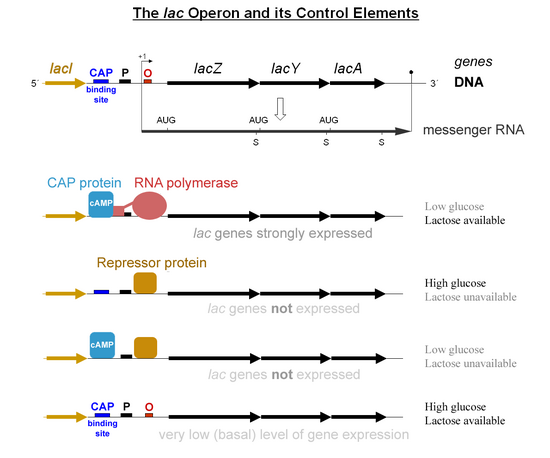
Специфический контроль генов lac зависит от доступности субстрата лактозы для бактерии. Белки не вырабатываются бактерией, когда лактоза недоступна в качестве источника углерода. Гены lac организованы в оперон ; то есть они ориентированы в одном направлении, непосредственно примыкая к хромосоме, и ко-транскрибируются в одну полицистронную молекулу мРНК. Транскрипция всех генов начинается со связывания фермента РНК-полимеразы (РНКП), ДНК-связывающего белка , который связывается со специфическим сайтом связывания ДНК, промотором , непосредственно выше генов. Связыванию РНК-полимеразы с промотором способствует белок-активатор катаболита, связанный с цАМФ (CAP, также известный как белок-рецептор цАМФ). [6] Однако ген lacI (регуляторный ген для lac оперона) вырабатывает белок, который блокирует связывание РНКП с оператором оперона. Этот белок может быть удален только тогда, когда с ним связывается аллолактоза и инактивирует его. Белок, который образуется геном lacI , известен как lac-репрессор. Тип регуляции, которому подвергается lac- оперон, называется отрицательным индуцируемым, что означает, что ген выключается регуляторным фактором ( lac -репрессором), если не добавлена какая-либо молекула (лактоза). После удаления репрессора РНК-полимераза затем приступает к транскрипции всех трех генов ( lacZYA ) в мРНК. Каждый из трех генов на цепи мРНК имеет свою собственную последовательность Шайна-Дальгарно , поэтому гены транслируются независимо. [7] Последовательность ДНК lac - оперона E. coli , мРНК lacZYA и генов lacI доступны в GenBank (просмотр).
Первый механизм контроля — это регуляторный ответ на лактозу, который использует внутриклеточный регуляторный белок, называемый лактозным репрессором, для препятствования образованию β-галактозидазы в отсутствие лактозы. Ген lacI , кодирующий репрессор, находится рядом с lac- опероном и всегда экспрессируется ( конститутивно ). Если в питательной среде отсутствует лактоза, репрессор очень плотно связывается с короткой последовательностью ДНК сразу за промотором около начала lacZ, называемой lac-оператором . Связывание репрессора с оператором мешает связыванию РНК-полимеразы с промотором, и поэтому мРНК, кодирующая LacZ и LacY, производится только на очень низких уровнях. Однако, когда клетки выращиваются в присутствии лактозы, метаболит лактозы, называемый аллолактозой, произведенный из лактозы продуктом гена lacZ , связывается с репрессором, вызывая аллостерический сдвиг. Измененный таким образом репрессор не может связываться с оператором, что позволяет РНК-полимеразе транскрибировать гены lac и тем самым приводит к более высоким уровням кодируемых белков.
Второй механизм контроля — это реакция на глюкозу, которая использует гомодимер белка-активатора катаболита (CAP) для значительного увеличения продукции β-галактозидазы при отсутствии глюкозы. Циклический аденозинмонофосфат (цАМФ) — это сигнальная молекула, распространенность которой обратно пропорциональна распространенности глюкозы. Он связывается с CAP, что, в свою очередь, позволяет CAP связываться с сайтом связывания CAP (последовательность ДНК длиной 16 п.н. выше промотора слева на диаграмме ниже, примерно на 60 п.н. выше сайта начала транскрипции) [8] , что помогает РНК-полимеразе связываться с ДНК. При отсутствии глюкозы концентрация цАМФ высока, и связывание CAP-цАМФ с ДНК значительно увеличивает продукцию β-галактозидазы, позволяя клетке гидролизовать лактозу и высвобождать галактозу и глюкозу.
Совсем недавно было показано, что исключение индуктора блокирует экспрессию lac оперона при наличии глюкозы. Глюкоза транспортируется в клетку с помощью PEP-зависимой фосфотрансферазной системы . Фосфатная группа фосфоенолпирувата переносится через каскад фосфорилирования, состоящий из общих белков PTS (фосфотрансферазная система) HPr и EIA и специфичных для глюкозы белков PTS EIIA Glc и EIIB Glc , цитоплазматического домена переносчика глюкозы EII. Транспорт глюкозы сопровождается ее фосфорилированием EIIB Glc , отводя фосфатную группу от других белков PTS, включая EIIA Glc . Нефосфорилированная форма EIIA Glc связывается с lac пермеазой и не дает ей переносить лактозу в клетку. Поэтому, если присутствуют и глюкоза, и лактоза, транспорт глюкозы блокирует транспорт индуктора lac оперона . [9]

Lac -репрессор — это четырехкомпонентный белок, тетрамер с идентичными субъединицами. Каждая субъединица содержит мотив спираль-поворот-спираль (HTH), способный связываться с ДНК. Операторный участок, где связывается репрессор, представляет собой последовательность ДНК с инвертированной повторной симметрией. Два полуучастка ДНК оператора вместе связываются с двумя субъединицами репрессора. Хотя другие две субъединицы репрессора ничего не делают в этой модели, это свойство не было понято в течение многих лет.
В конце концов было обнаружено, что в регуляции lac участвуют два дополнительных оператора . [10] Один (O 3 ) находится примерно в −90 п.н. выше O 1 в конце гена lacI , а другой (O 2 ) находится примерно в +410 п.н. ниже O 1 в ранней части lacZ . Эти два сайта не были обнаружены в ранней работе, поскольку они имеют избыточные функции, а отдельные мутации не сильно влияют на репрессию. Одиночные мутации либо в O 2 , либо в O 3 имеют только 2–3-кратные эффекты. Однако их важность демонстрируется тем фактом, что двойной мутант, дефектный как в O 2 , так и в O 3, резко дерепрессируется (примерно в 70 раз).
В текущей модели lac -репрессор связан одновременно с основным оператором O 1 и с O 2 или O 3 . Промежуточная ДНК выпячивается из комплекса. Избыточная природа двух второстепенных операторов предполагает, что важен не конкретный петлевой комплекс. Одна из идей заключается в том, что система работает посредством связывания; если связанный репрессор на мгновение высвобождается из O 1 , связывание с второстепенным оператором удерживает его поблизости, так что он может быстро повторно связать себя. Это увеличит сродство репрессора к O 1 .
Репрессор является аллостерическим белком , то есть он может принимать одну из двух слегка отличающихся форм, которые находятся в равновесии друг с другом. В одной форме репрессор будет связываться с операторной ДНК с высокой специфичностью, а в другой форме он теряет свою специфичность. Согласно классической модели индукции, связывание индуктора, либо аллолактозы, либо ИПТГ, с репрессором влияет на распределение репрессора между двумя формами. Таким образом, репрессор со связанным индуктором стабилизируется в не-ДНК-связывающей конформации. Однако эта простая модель не может быть всей историей, потому что репрессор довольно стабильно связан с ДНК, но быстро высвобождается при добавлении индуктора. Поэтому кажется очевидным, что индуктор также может связываться с репрессором, когда репрессор уже связан с ДНК. До сих пор не совсем известно, каков точный механизм связывания. [11]
Неспецифическое связывание репрессора с ДНК играет решающую роль в репрессии и индукции Lac-оперона. Специфическим местом связывания для белка Lac-репрессора является оператор. Неспецифическое взаимодействие опосредуется в основном заряд-зарядными взаимодействиями, в то время как связывание с оператором усиливается гидрофобными взаимодействиями. Кроме того, существует множество неспецифических последовательностей ДНК, с которыми может связываться репрессор. По сути, любая последовательность, которая не является оператором, считается неспецифической. Исследования показали, что без наличия неспецифического связывания индукция (или нерепрессия) Lac-оперона не могла бы происходить даже при насыщенных уровнях индуктора. Было показано, что без неспецифического связывания базальный уровень индукции в десять тысяч раз меньше, чем наблюдается обычно. Это происходит потому, что неспецифическая ДНК действует как своего рода «слив» для белков-репрессоров, отвлекая их от оператора. Неспецифические последовательности уменьшают количество доступного репрессора в клетке. Это, в свою очередь, уменьшает количество индуктора, необходимого для снятия подавления системы. [12]

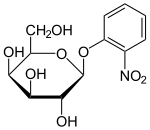


Описан ряд производных или аналогов лактозы, которые полезны для работы с lac- опероном. Эти соединения в основном представляют собой замещенные галактозиды, где глюкозный фрагмент лактозы заменен другой химической группой.
Экспериментальным микроорганизмом, использованным Франсуа Жакобом и Жаком Моно , была обычная лабораторная бактерия E. coli , но многие из основных регуляторных концепций, открытых Жакобом и Моно, являются основополагающими для клеточной регуляции во всех организмах. [17] Ключевая идея заключается в том, что белки не синтезируются, когда они не нужны — E. coli сохраняет клеточные ресурсы и энергию, не производя три белка Lac, когда нет необходимости метаболизировать лактозу, например, когда доступны другие сахара, такие как глюкоза . В следующем разделе обсуждается, как E. coli контролирует определенные гены в ответ на метаболические потребности.
Во время Второй мировой войны Моно изучал эффекты комбинаций сахаров в качестве источников питательных веществ для E. coli и B. subtilis . Моно продолжил аналогичные исследования, которые проводили другие ученые с бактериями и дрожжами. Он обнаружил, что бактерии, выращенные с двумя различными сахарами, часто демонстрируют две фазы роста. Например, если были предоставлены и глюкоза, и лактоза, то сначала метаболизировалась глюкоза (фаза роста I, см. Рисунок 2), а затем лактоза (фаза роста II). Лактоза не метаболизировалась в течение первой части диауксиновой кривой роста, поскольку β-галактозидаза не вырабатывалась, когда в среде присутствовали и глюкоза, и лактоза. Моно назвал это явление диауксин . [18]

Затем Моно сосредоточил свое внимание на индукции образования β-галактозидазы, которая происходила, когда лактоза была единственным сахаром в культуральной среде. [19]
Концептуальным прорывом Жакоба и Моно [20] стало признание различия между регуляторными веществами и участками, где они действуют, изменяя экспрессию генов. Бывший солдат, Жакоб использовал аналогию с бомбардировщиком, который сбрасывает свой смертоносный груз при получении специальной радиопередачи или сигнала. Для работы системы требуются как наземный передатчик, так и приемник в самолете. Теперь предположим, что обычный передатчик сломан. Эту систему можно заставить работать, внедрив второй, функциональный передатчик. Для сравнения, сказал он, рассмотрим бомбардировщик с неисправным приемником. Поведение этого бомбардировщика нельзя изменить, внедрив второй, функциональный самолет.
Для анализа регуляторных мутантов оперона lac Джейкоб разработал систему, с помощью которой вторая копия генов lac ( lacI с его промотором и lacZYA с промотором и оператором) может быть введена в одну клетку. Культура таких бактерий, которые являются диплоидными для генов lac, но в остальном нормальными, затем тестируется на регуляторный фенотип. В частности, определяется, производятся ли LacZ и LacY даже в отсутствие IPTG (из-за того, что репрессор лактозы , продуцируемый мутантным геном, нефункционален). Этот эксперимент, в котором гены или кластеры генов тестируются попарно, называется тестом на комплементарность .

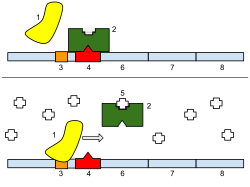
Этот тест проиллюстрирован на рисунке ( lacA опущен для простоты). Сначала показаны определенные гаплоидные состояния (т. е. клетка несет только одну копию генов lac ). Панель (a) показывает репрессию, (b) показывает индукцию IPTG, а (c) и (d) показывают эффект мутации в гене lacI или операторе соответственно. На панели (e) показан тест комплементации для репрессора. Если одна копия генов lac несет мутацию в lacI , но вторая копия является диким типом для lacI , результирующий фенотип является нормальным, но lacZ экспрессируется при воздействии индуктора IPTG. Мутации, влияющие на репрессор, называются рецессивными по отношению к дикому типу (и этот дикий тип является доминантным ), и это объясняется тем, что репрессор — это небольшой белок, который может диффундировать в клетке. Копия оперона lac , смежная с дефектным геном lacI, эффективно отключается белком, произведенным из второй копии lacI .
Если тот же эксперимент провести с использованием мутации оператора, то будет получен другой результат (панель (f)). Фенотип клетки, несущей один мутантный и один дикий тип сайта оператора, заключается в том, что LacZ и LacY продуцируются даже в отсутствие индуктора IPTG; поскольку поврежденный сайт оператора не позволяет репрессору связываться для ингибирования транскрипции структурных генов. Мутация оператора является доминирующей. Когда сайт оператора, где должен связываться репрессор, поврежден мутацией, наличие второго функционального сайта в той же клетке не влияет на экспрессию генов, контролируемых мутантным сайтом.
Более сложная версия этого эксперимента использует маркированные опероны для различения двух копий генов lac и показывает, что нерегулируемый структурный ген(ы) является(ются) тем(ами), который(е) находится(ются) рядом с мутантным оператором (панель (g). Например, предположим, что одна копия помечена мутацией, инактивирующей lacZ , так что она может производить только белок LacY, в то время как вторая копия несет мутацию, влияющую на lacY , и может производить только LacZ. В этой версии только копия оперона lac , которая находится рядом с мутантным оператором, экспрессируется без IPTG. Мы говорим, что мутация оператора является цис-доминантной , она доминирует над диким типом, но влияет только на копию оперона, которая находится непосредственно рядом с ней.
Это объяснение вводит в заблуждение в важном смысле, потому что оно исходит из описания эксперимента, а затем объясняет результаты в терминах модели. Но на самом деле часто верно, что сначала появляется модель, а эксперимент специально разрабатывается для проверки модели. Жакоб и Моно сначала предположили, что в ДНК должен быть участок со свойствами оператора, а затем разработали свои тесты на комплементарность, чтобы показать это.
Доминирование мутантов операторов также предполагает процедуру их специфического отбора. Если регуляторные мутанты выбираются из культуры дикого типа с использованием фенил-Гал, как описано выше, мутации операторов редки по сравнению с мутантами репрессоров, поскольку размер мишени очень мал. Но если вместо этого мы начнем со штамма, который несет две копии всего региона lac (то есть диплоидного для lac ), мутации репрессоров (которые все еще происходят) не восстанавливаются, поскольку комплементация вторым геном lacI дикого типа дает фенотип дикого типа. Напротив, мутация одной копии оператора дает мутантный фенотип, поскольку она доминирует над второй копией дикого типа.
Объяснение диаксии зависело от характеристики дополнительных мутаций, влияющих на гены lac , отличных от тех, которые объясняются классической моделью. Впоследствии были идентифицированы два других гена, cya и crp , которые картировались далеко от lac , и которые при мутации приводят к снижению уровня экспрессии в присутствии IPTG и даже в штаммах бактерии, не имеющих репрессора или оператора. Открытие цАМФ в E. coli привело к демонстрации того, что мутанты с дефектом гена cya , но не гена crp , могут быть восстановлены до полной активности путем добавления цАМФ в среду.
Ген cya кодирует аденилатциклазу, которая производит цАМФ. У мутанта cya отсутствие цАМФ делает экспрессию генов lacZYA более чем в десять раз ниже нормы. Добавление цАМФ корректирует низкую экспрессию Lac, характерную для мутантов cya . Второй ген, crp , кодирует белок, называемый белком-активатором катаболита (CAP) или белком-рецептором цАМФ (CRP). [22]
Однако ферменты метаболизма лактозы производятся в небольших количествах в присутствии как глюкозы, так и лактозы (иногда это называется текучее выражение) из-за того, что РНК-полимераза иногда может связываться и инициировать транскрипцию даже в отсутствие CAP. Текучее выражение необходимо для того, чтобы обеспечить метаболизм некоторого количества лактозы после того, как источник глюкозы израсходован, но до того, как lac -выражение полностью активируется.
В итоге:
Задержка между фазами роста отражает время, необходимое для выработки достаточного количества ферментов, метаболизирующих лактозу. Во-первых, регуляторный белок CAP должен собраться на промоторе lac , что приводит к увеличению выработки lac мРНК . Более доступные копии lac мРНК приводят к выработке (см. перевод ) значительно большего количества копий LacZ (β-галактозидаза, для метаболизма лактозы) и LacY (пермеаза лактозы для транспортировки лактозы в клетку). После задержки, необходимой для повышения уровня ферментов, метаболизирующих лактозу, бактерии вступают в новую быструю фазу роста клеток .
Две загадки катаболитной репрессии связаны с тем, как уровни цАМФ связаны с наличием глюкозы, и, во-вторых, почему клетки вообще должны беспокоиться. После расщепления лактозы она фактически образует глюкозу и галактозу (легко преобразуются в глюкозу). С точки зрения метаболизма лактоза является таким же хорошим источником углерода и энергии, как и глюкоза. Уровень цАМФ связан не с внутриклеточной концентрацией глюкозы, а со скоростью транспорта глюкозы, которая влияет на активность аденилатциклазы. (Кроме того, транспорт глюкозы также приводит к прямому ингибированию пермеазы лактозы.) О том, почему E. coli работает таким образом, можно только догадываться. Все кишечные бактерии ферментируют глюкозу, что предполагает, что они часто с ней сталкиваются. Возможно, что небольшая разница в эффективности транспорта или метаболизма глюкозы и лактозы делает для клеток выгодным регулировать lac- оперон таким образом. [23]
Ген lac и его производные пригодны для использования в качестве репортерного гена в ряде методов селекции на основе бактерий, таких как двухгибридный анализ, в котором необходимо определить успешное связывание транскрипционного активатора с определенной последовательностью промотора. [16] В чашках LB , содержащих X-gal , изменение цвета от белых колоний до оттенка синего соответствует примерно 20–100 единицам β-галактозидазы, в то время как тетразолиевая лактоза и лактозная среда MacConkey имеют диапазон 100–1000 единиц, будучи наиболее чувствительными в верхней и нижней частях этого диапазона соответственно. [16] Поскольку и лактозная, и тетразолиевая лактозная среды MacConkey полагаются на продукты распада лактозы, они требуют присутствия как генов lacZ , так и lacY . Таким образом, многие методы слияния lac , включающие только ген lacZ, подходят для чашек X-gal [16] или жидких бульонов ONPG . [24]