Малоновая кислота — дикарбоновая кислота со структурой CH2 ( COOH) 2 . Ионизированная форма малоновой кислоты, а также ее эфиры и соли известны как малонаты . Например, диэтилмалонат — это диэтиловый эфир малоновой кислоты . Название происходит от греческого слова μᾶλον ( малон ), что означает «яблоко».
Малоновая кислота [3] — это природное вещество, содержащееся во многих фруктах и овощах. [4] Существует предположение, что цитрусовые , выращенные в органическом сельском хозяйстве, содержат больше малоновой кислоты, чем фрукты, выращенные в традиционном сельском хозяйстве. [5]
Малоновая кислота была впервые получена в 1858 году французским химиком Виктором Дессенем путем окисления яблочной кислоты . [3] [6]
Структура была определена с помощью рентгеновской кристаллографии [7] , а обширные данные о свойствах, включая данные по термохимии конденсированной фазы, доступны в Национальном институте стандартов и технологий . [8] Классический способ получения малоновой кислоты начинается с хлоруксусной кислоты : [9]

Карбонат натрия генерирует натриевую соль , которая затем реагирует с цианидом натрия , чтобы получить натриевую соль цианоуксусной кислоты через нуклеофильное замещение . Нитрильная группа может быть гидролизована гидроксидом натрия до малоната натрия, а подкисление дает малоновую кислоту. Однако в промышленности малоновую кислоту получают путем гидролиза диметилмалоната или диэтилмалоната . [ 10] Ее также получают путем ферментации глюкозы . [11]
Малоновая кислота реагирует как типичная карбоновая кислота, образуя амидные , эфирные и хлоридные производные. [12] Малоновый ангидрид может быть использован в качестве промежуточного продукта для получения моноэфирных или амидных производных, в то время как малонилхлорид наиболее полезен для получения диэфиров или диамидов. В хорошо известной реакции малоновая кислота конденсируется с мочевиной с образованием барбитуровой кислоты . Малоновая кислота также может быть конденсирована с ацетоном с образованием кислоты Мельдрума , универсального промежуточного продукта в дальнейших превращениях. Эфиры малоновой кислоты также используются в качестве синтона − CH 2 COOH в синтезе малонового эфира .
Малоновая кислота является ключевым компонентом в реакции Бриггса-Раушера , классическом примере колебательной химической реакции . [13]
Малоновая кислота используется для получения a,b-ненасыщенных карбоновых кислот путем конденсации и декарбоксилирования. Коричные кислоты получают следующим образом:
В этом процессе, так называемой конденсации Кнёвенагеля , малоновая кислота конденсируется с карбонильной группой альдегида или кетона с последующим декарбоксилированием .

При конденсации малоновой кислоты в горячем пиридине конденсация сопровождается декарбоксилированием , так называемой модификацией Дёбнера . [14] [15] [16]

Малоновая кислота нелегко образует ангидрид , вместо этого при дегидратации образуется недокись углерода :
Превращение достигается путем нагревания сухой смеси пентоксида фосфора (P4O10 ) и малоновой кислоты. [ 17] Он реагирует аналогично малоновому ангидриду , образуя малонаты. [18]
Малоновая кислота является предшественником специальных полиэфиров . Она может быть преобразована в 1,3-пропандиол для использования в полиэфирах и полимерах (польза которых неясна, хотя). Она также может быть компонентом алкидных смол , которые используются в ряде покрытий для защиты от повреждений, вызванных УФ-излучением, окислением и коррозией. Одним из применений малоновой кислоты является производство покрытий в качестве сшивающего агента для порошковых покрытий с низкой температурой отверждения, которые становятся все более ценными для чувствительных к теплу субстратов и желания ускорить процесс нанесения покрытий. [19] Мировой рынок покрытий для автомобилей оценивался в 18,59 млрд долларов в 2014 году с прогнозируемым совокупным годовым темпом роста 5,1% до 2022 года. [20]
Он используется в ряде производственных процессов как высокоценный специальный химикат, включая электронную промышленность, промышленность ароматизаторов и отдушек, [4] специальные растворители, сшивание полимеров и фармацевтическую промышленность. В 2004 году ежегодное мировое производство малоновой кислоты и связанных с ней диэфиров составило более 20 000 метрических тонн. [21] Потенциальный рост этих рынков может быть результатом достижений в области промышленной биотехнологии, которая стремится заменить химикаты на основе нефти в промышленных приложениях.
В 2004 году Министерство энергетики США включило малоновую кислоту в список 30 лучших химических веществ, которые можно производить из биомассы. [22]
В пищевой и фармацевтической промышленности малоновую кислоту можно использовать для контроля кислотности, либо в качестве вспомогательного вещества в фармацевтических составах, либо в качестве натуральной консервирующей добавки для пищевых продуктов. [4]
Малоновая кислота используется в качестве строительного материала для производства многочисленных ценных соединений, [23] включая ароматизаторы и отдушки гамма-ноналактон, коричную кислоту и фармацевтическое соединение вальпроат .
Малоновая кислота (до 37,5% по весу) использовалась для сшивания кукурузного и картофельного крахмала с целью получения биоразлагаемого термопластика; процесс осуществляется в воде с использованием нетоксичных катализаторов. [24] [25] Полимеры на основе крахмала составляли 38% мирового рынка биоразлагаемых полимеров в 2014 году, при этом упаковка для пищевых продуктов, пенопластовая упаковка и мешки для компоста были крупнейшими сегментами конечного использования. [26]
Компания Eastman Kodak и другие используют малоновую кислоту и ее производные в качестве хирургического клея. [27]
Если повышенный уровень малоновой кислоты сопровождается повышенным уровнем метилмалоновой кислоты , это может указывать на метаболическое заболевание комбинированную малоновую и метилмалоновую ацидурию (CMAMMA). Рассчитав соотношение малоновой кислоты к метилмалоновой кислоте в плазме крови, CMAMMA можно отличить от классической метилмалоновой ацидемии . [28]
Малоновая кислота является предшественником митохондриального синтеза жирных кислот (mtFASII), в котором она преобразуется в малонил-КоА с помощью ацил-КоА-синтетазы, члена семейства 3 (ACSF3). [29] [30]
Кроме того, производное кофермента А малоната, малонил-КоА, является важным предшественником в цитозольном биосинтезе жирных кислот наряду с ацетил-КоА . Малонил-КоА образуется там из ацетил-КоА под действием ацетил-КоА-карбоксилазы , а малонат переносится на ацилпереносящий белок для присоединения к жирнокислотной цепи.
Малоновая кислота является классическим примером конкурентного ингибитора фермента сукцинатдегидрогеназы (комплекс II) в дыхательной цепи переноса электронов . [31] Она связывается с активным центром фермента, не вступая в реакцию, конкурируя с обычным субстратом сукцинатом , но не имея группы −CH 2 CH 2 − , необходимой для дегидрирования. Это наблюдение было использовано для определения структуры активного центра в сукцинатдегидрогеназе. Ингибирование этого фермента снижает клеточное дыхание. [32] [33] Поскольку малоновая кислота является естественным компонентом многих продуктов питания, она присутствует у млекопитающих, включая людей. [34]
Фторированная версия малоновой кислоты — дифтормалоновая кислота.[1]
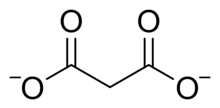
Малоновая кислота является дипротонной ; то есть она может отдавать два протона на молекулу. Ее первый протон равен 2,8, а второй — 5,7. [2] Таким образом, ион малоната может быть H O O C CH 2 COO − или C H 2 (C O O) 2−2. Малонатные или пропандиоатные соединения включают соли и эфиры малоновой кислоты, такие как