Фосфатно-буферный физиологический раствор ( PBS ) — это буферный раствор (pH ~ 7,4), который обычно используется в биологических исследованиях . Это водный солевой раствор, содержащий динатрийгидрофосфат , хлорид натрия и, в некоторых составах, хлорид калия и дигидрофосфат калия . Буфер помогает поддерживать постоянный pH. Осмолярность и концентрация ионов в растворах изотоничны , то есть соответствуют таковым в организме человека.
PBS имеет множество применений, поскольку он изотоничен и нетоксичен для большинства клеток. К таким применениям относятся разбавление веществ и промывание контейнеров для клеток. PBS с ЭДТА также используется для отделения прикрепленных и слипшихся клеток. Однако нельзя добавлять двухвалентные металлы , такие как цинк , поскольку это приведет к осаждению. Для таких применений рекомендуются буферы Гуда . Было показано, что PBS является приемлемой альтернативой вирусной транспортной среде в отношении транспортировки и хранения РНК-вирусов, таких как SARS-CoV-2. [1]
Существует много различных способов приготовления растворов PBS, наиболее распространенными из которых являются фосфатно-солевой буфер Дульбекко (DPBS) [2] и протокол Колд-Спринг-Харбор. [3] Некоторые составы DPBS не содержат калий и магний, в то время как другие содержат кальций и/или магний (в зависимости от того, используется ли буфер на живой или фиксированной ткани: последний не требует CaCl 2 или MgCl 2 ).
Начните с 800 мл дистиллированной воды, чтобы растворить все соли. Добавьте дистиллированную воду до общего объема 1 литр. Полученный 1× PBS будет иметь конечную концентрацию 157 мМ Na + , 140 мМ Cl − , 4,45 мМ K + , 10,1 мМ HPO 4 2− , 1,76 мМ H 2 PO 4 − и pH 7,96. Добавьте 2,84 мМ HCl, чтобы сместить буфер до 7,3 мМ HPO 4 2− и 4,6 мМ H 2 PO 4 − для конечного pH 7,4 и концентрации Cl − 142 мМ.
pH PBS составляет ~7,4. При приготовлении буферных растворов рекомендуется всегда измерять pH напрямую с помощью pH-метра. При необходимости pH можно отрегулировать с помощью соляной кислоты или гидроксида натрия.
PBS также можно приготовить, используя имеющиеся в продаже буферные таблетки PBS или пакетики. [4]
При использовании в клеточной культуре раствор можно разлить по аликвотам и стерилизовать автоклавированием или фильтрацией . Стерилизация может не потребоваться в зависимости от его использования. PBS можно хранить при комнатной температуре или в холодильнике. Однако концентрированные исходные растворы могут выпадать в осадок при охлаждении и должны храниться при комнатной температуре до полного растворения осадка перед использованием.
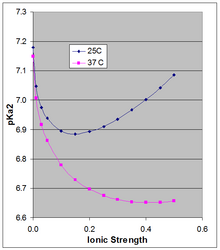
Уравнение Хендерсона-Хассельбаха дает pH раствора относительно p K a пары кислота-основание. Однако p K a зависит от ионной силы и температуры, и по мере его смещения будет меняться и pH раствора, основанного на этой паре кислота-основание. Поскольку двузарядный [HPO 4 ] 2− стабилизируется большей ионной силой, чем однозарядный [H 2 PO 4 ] − , их p K a несколько зависит от ионной силы. Часто цитируемое p K a ~7,2 является значением, экстраполированным на нулевую ионную силу, и неприменимо при физиологической ионной силе.
Филлипс и др. [5] измерили p K a при 10, 25 и 37 °C при различных ионных силах. Для последних двух температур они сообщают p K a в уравнениях Дебая-Хюккеля (построенных на сопроводительном рисунке для μ до 0,5 M):
при 25 °C: pKa 2 = 7,18 − 1,52 sqrt(μ) + 1,96 μ
при 37 °C: pKa 2 = 7,15 − 1,56 sqrt(μ) + 1,22 μ
P K a 0 слабо зависит от температуры. Филлипс и др. сообщили о ∆H 0 при 25 °C, равной 760 кал/моль (3180 Дж/моль), и о линейной зависимости p K a 0 от 1/ T ( уравнение Вант-Гоффа ). Положительная ∆H 0 приводит к увеличению K a , и, таким образом, к уменьшению p K a 0 с ростом температуры, изменение pKa 0 составляет 166 × изменение (1/ T ), что около 25 °C приводит к изменению p K a 0 на −0,00187 на градус. Это строго применимо к экстраполированному термодинамическому p K a 0 при бесконечном разбавлении, и, как показано на рисунке, температурный эффект может быть намного больше при более высокой ионной силе.