Клатрат – это химическое вещество , состоящее из решетки , которая улавливает или удерживает молекулы. Слово клатрат происходит от латинского clathratus ( clatratus ), что означает «с решетками, с решеткой ». [1] Большинство клатратных соединений являются полимерными и полностью окутывают молекулу гостя, но в современном использовании клатраты также включают комплексы хозяин-гость и соединения включения . [2] Согласно ИЮПАК , клатраты представляют собой соединения включения, «в которых молекула-гость находится в клетке, образованной молекулой-хозяином или решеткой молекул-хозяев». [3] Этот термин относится ко многим молекулярным хозяевам, включая каликсарены и циклодекстрины и даже к некоторым неорганическим полимерам, таким как цеолиты .
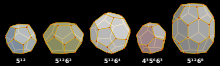
Клатраты можно разделить на две категории: клатратные гидраты и неорганические клатраты. Каждый клатрат состоит из фреймворка и гостей, находящихся в фреймворке. Наиболее распространенные кристаллические структуры клатрата могут состоять из полостей, таких как додекаэдрические , тетракаидекаэдрические и гексакаидекаэдрические полости.
Молярная доля воды большинства клатратных гидратов составляет 85%. Клатратные гидраты происходят из органических каркасов с водородными связями . Эти каркасы изготавливаются из молекул, которые «самоассоциируются» за счет множественных взаимодействий водородных связей. Маленькие молекулы или газы (например, метан, углекислый газ, водород) могут быть заключены в гидраты в качестве гостя. Идеальное соотношение «гость/хозяин» для клатратных гидратов составляет от 0,8 до 0,9. Взаимодействие гостя с хозяином ограничивается силами Ван дер Ваальса . Определенные исключения существуют у семиклатратов , где гости включаются в структуру хозяина посредством водородных связей со структурой хозяина. Гидраты образуются часто при частичном заполнении гостей и разрушаются при отсутствии гостей, занимающих водные клетки. Как и лед, клатратные гидраты стабильны при низких температурах и высоком давлении и обладают сходными свойствами, такими как электрическое сопротивление. Клатратные гидраты встречаются в природе и могут быть обнаружены в вечной мерзлоте и океанических отложениях. Гидраты также можно синтезировать путем затравочной кристаллизации или использования аморфных предшественников для зародышеобразования. [4]
В отличие от гидратов, неорганические клатраты имеют ковалентно связанный каркас из неорганических атомов с гостями, обычно состоящими из щелочных или щелочноземельных металлов . Из-за более прочной ковалентной связи клетки часто меньше, чем гидраты. Атомы гостя взаимодействуют с хозяином посредством ионных или ковалентных связей. Следовательно, частичное замещение атомов-гостей следует правилам Цинтля , так что заряд всего соединения сохраняется. Большинство неорганических клатратов имеют полное заполнение своих каркасных клеток атомом-гостем, чтобы находиться в стабильной фазе. Неорганические клатраты можно синтезировать прямой реакцией с использованием шаровой мельницы при высоких температурах или высоких давлениях. Кристаллизация из расплава по другому распространенному пути синтеза. Благодаря большому разнообразию состава видов-хозяев и гостей неорганические клатраты значительно более разнообразны по химическому составу и обладают широким спектром свойств. В частности, неорганические клатраты могут быть как изолятором, так и сверхпроводником (Ba 8 Si 46 ). Общим свойством неорганических клатратов, привлекавшим исследователей, является низкая теплопроводность . Низкая теплопроводность объясняется способностью атома-гостья «греметь» внутри каркаса-хозяина. Свобода движения атомов-гостей рассеивает фононы , переносящие тепло. [4]


Клатраты были исследованы для многих применений, включая хранение газа, добычу газа, разделение газа, опреснение , термоэлектрику , фотогальванику и батареи.
2CCl4.jpg/440px-Cd(CN)2CCl4.jpg)

Клатратные гидраты были открыты в 1810 году Хамфри Дэви . [9] Клатраты изучались П. Пфайфером в 1927 г., а в 1930 г. Э. Гертель определил «молекулярные соединения» как вещества, разлагающиеся на отдельные компоненты по закону действия масс в растворенном или газообразном состоянии. В 1934 году Хаммершмидт обнаружил, что клатратные гидраты образуют засоры в газопроводах, что привело к увеличению количества исследований по предотвращению образования гидратов. [10] В 1945 году Х. М. Пауэлл проанализировал кристаллическую структуру этих соединений и назвал их клатратами . Производство газа с помощью гидратов метана с тех пор было реализовано и испытано для производства энергии в Японии и Китае. [4]
Соединения включения часто представляют собой молекулы, тогда как клатраты обычно являются полимерными . Интеркаляционные соединения не являются трехмерными, в отличие от клатратных соединений. Фотолитически чувствительные клеточные соединения были исследованы в качестве контейнеров для высвобождения лекарственного средства или реагента . [11]
Цеолиты — это еще один тип кристаллических структур, образующих каркас с полостями, в которых могут обитать виды-гости. В отличие от клатратов, цеолиты представляют собой тетраэдры, соединяющие четыре атома кислорода, окружающие катион. [ нужна цитата ] Гости также не обязаны заполнять открытые полости. Структуры цеолита определяются разнообразными строительными единицами каркаса, в отличие от полых структур в клатратах. Подобные приложения были исследованы.
Клатрасил кремнезема представляет собой соединения, структурно подобные клатратным гидратам с каркасом SiO 2 , и их можно обнаружить в ряде морских отложений. [12]