
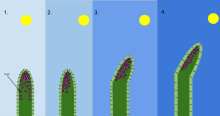
В биологии фототропизм — это рост организма в ответ на световой стимул . Фототропизм чаще всего наблюдается у растений , но может встречаться и у других организмов, таких как грибы . Клетки растения, которые находятся дальше всего от света, содержат гормон, называемый ауксином , который реагирует на фототропизм. Это приводит к тому, что у растения вытягиваются клетки на самой дальней стороне от света. Фототропизм — один из многих тропизмов растений , или движений, которые реагируют на внешние стимулы. Рост по направлению к источнику света называется положительным фототропизмом , тогда как рост от света называется отрицательным фототропизмом . Отрицательный фототропизм не следует путать со скототропизмом, который определяется как рост по направлению к темноте, тогда как отрицательный фототропизм может относиться как к росту по направлению от источника света, так и к темноте. [1] Большинство побегов растений проявляют положительный фототропизм и перестраивают свои хлоропласты в листьях, чтобы максимизировать фотосинтетическую энергию и способствовать росту. [2] [3] Некоторые верхушки побегов виноградной лозы проявляют отрицательный фототропизм, который позволяет им расти в направлении темных, твердых объектов и взбираться по ним. Сочетание фототропизма и гравитропизма позволяет растениям расти в правильном направлении. [4]
Существует несколько сигнальных молекул , которые помогают растению определить, откуда исходит источник света, и они активируют несколько генов, которые изменяют градиенты гормонов, позволяя растению расти по направлению к свету. Самый кончик растения известен как колеоптиль , который необходим для восприятия света. [2] Средняя часть колеоптиля — это область, где происходит изгиб побега. Гипотеза Холодни-Вента , разработанная в начале 20-го века, предсказывает, что при наличии асимметричного света ауксин будет перемещаться в сторону затененной стороны и способствовать удлинению клеток на этой стороне, заставляя растение изгибаться по направлению к источнику света. [5] Ауксины активируют протонные насосы, снижая pH в клетках на темной стороне растения. Это подкисление области клеточной стенки активирует ферменты, известные как экспансины , которые разрушают водородные связи в структуре клеточной стенки, делая клеточные стенки менее жесткими. Кроме того, повышенная активность протонного насоса приводит к тому, что больше растворенных веществ поступает в растительные клетки на темной стороне растения, что увеличивает осмотический градиент между симпластом и апопластом этих растительных клеток. [6] Затем вода поступает в клетки по своему осмотическому градиенту, что приводит к увеличению тургорного давления. Уменьшение прочности клеточной стенки и увеличение тургорного давления выше порога текучести [7] заставляет клетки набухать, оказывая механическое давление, которое приводит к фототропному движению.
Было обнаружено, что белки, кодируемые второй группой генов, генами PIN , играют важную роль в фототропизме. Они являются переносчиками ауксина, и считается, что они отвечают за поляризацию местоположения ауксина. В частности, PIN3 был идентифицирован как первичный переносчик ауксина. [8] Возможно, что фототропины получают свет и ингибируют активность PINOID киназы (PID), которая затем стимулирует активность PIN3 . Эта активация PIN3 приводит к асимметричному распределению ауксина, что затем приводит к асимметричному удлинению клеток в стебле. Мутанты pin3 имели более короткие гипокотиль и корни, чем дикий тип, и тот же фенотип был замечен у растений, выращенных с ингибиторами оттока ауксина. [9] С помощью иммунозолотой маркировки анти-PIN3 было обнаружено движение белка PIN3. PIN3 обычно локализуется на поверхности гипокотиля и стебля, но также интернализуется в присутствии брефельдина А (BFA), ингибитора экзоцитоза. Этот механизм позволяет PIN3 перепозиционироваться в ответ на стимул окружающей среды. Считалось, что белки PIN3 и PIN7 играют роль в фототропизме, вызванном импульсом. Реакции кривизны у мутанта «pin3» были значительно снижены, но лишь немного снижены у мутантов «pin7». Существует некоторая избыточность между «PIN1», «PIN3» и «PIN7», но считается, что PIN3 играет большую роль в фототропизме, вызванном импульсом. [10]
Существуют фототропины, которые высоко экспрессируются в верхней области колеоптилей. Существует два основных фототропизма, это phot1 и phot2. Одиночные мутанты phot2 имеют фототропные реакции, как у дикого типа, но двойные мутанты phot1 phot2 не показывают никаких фототропных реакций. [4] Количество присутствующих PHOT1 и PHOT2 различается в зависимости от возраста растения и интенсивности света. В зрелых листьях Arabidopsis присутствует большое количество PHOT2 , и это также было замечено в ортологах риса. Экспрессия PHOT1 и PHOT2 изменяется в зависимости от присутствия синего или красного света. Наблюдалось снижение мРНК PHOT1 в присутствии света, но повышение регуляции транскрипта PHOT2. Уровни мРНК и белка, присутствующие в растении, зависели от возраста растения. Это говорит о том, что уровни экспрессии фототропина изменяются с созреванием листьев. [11] Зрелые листья содержат хлоропласты, которые необходимы для фотосинтеза. Перестройка хлоропластов происходит в различных световых условиях для максимизации фотосинтеза. Существует несколько генов, участвующих в фототропизме растений, включая гены NPH1 и NPL1 . Они оба участвуют в перестройке хлоропластов. [3] Было обнаружено , что двойные мутанты nph1 и npl1 имеют сниженные фототропные реакции. Фактически, оба гена избыточны в определении кривизны стебля.
Недавние исследования показывают, что несколько киназ AGC, за исключением PHOT1 и PHOT2, участвуют в фототропизме растений. Во-первых, PINOID, демонстрирующий индуцируемый светом паттерн экспрессии, определяет субклеточное перемещение PIN3 во время фототропных реакций посредством прямого фосфорилирования. Во-вторых, D6PK и его гомологи D6PKL модулируют активность транспорта ауксина PIN3, вероятно, также посредством фосфорилирования. В-третьих, выше D6PK/D6PKLs, PDK1.1 и PDK1.2 действуют как существенный активатор для этих киназ AGC. Интересно, что разные киназы AGC могут участвовать в разных этапах во время прогрессирования фототропного ответа. D6PK/D6PKLs демонстрируют способность фосфорилировать больше фосфозитов, чем PINOID.
В 2012 году Сакаи и Хага [12] описали, как различные концентрации ауксина могут возникать на затененной и освещенной стороне стебля, вызывая фототропную реакцию. Было предложено пять моделей в отношении фототропизма стебля , используя Arabidopsis thaliana в качестве исследуемого растения.

В первой модели входящий свет дезактивирует ауксин на светлой стороне растения, позволяя затененной части продолжать расти и в конечном итоге наклонять растение в сторону света. [12]
Во второй модели свет подавляет биосинтез ауксина на освещенной стороне растения, тем самым снижая концентрацию ауксина по сравнению с незатронутой стороной. [12]
В третьей модели существует горизонтальный поток ауксина как со светлой, так и с темной стороны растения. Входящий свет вызывает больший поток ауксина с открытой стороны на затененную, увеличивая концентрацию ауксина на затененной стороне и, таким образом, увеличивая рост. [12]
В четвертой модели показано, что растение, получающее свет, ингибирует ауксин базипетально вниз к открытой стороне, заставляя ауксин течь только вниз по затененной стороне. [12]
Модель пять охватывает элементы как модели 3, так и модели 4. Основной поток ауксина в этой модели идет от верхушки растения вертикально вниз к основанию растения, при этом часть ауксина перемещается горизонтально от основного потока ауксина к обеим сторонам растения. Получение света подавляет горизонтальный поток ауксина от основного вертикального потока ауксина к облученной открытой стороне. И согласно исследованию Сакаи и Хаги, наблюдаемое асимметричное распределение ауксина и последующая фототропная реакция в гипокотилях кажутся наиболее соответствующими этому пятому сценарию. [12]
Фототропизм в растениях, таких как Arabidopsis thaliana, направляется рецепторами синего света, называемыми фототропинами . [13] Другие светочувствительные рецепторы в растениях включают фитохромы , которые воспринимают красный свет [14] и криптохромы , которые воспринимают синий свет. [15] Различные органы растения могут проявлять различные фототропные реакции на разные длины волн света. Кончики стеблей проявляют положительные фототропные реакции на синий свет, в то время как кончики корней проявляют отрицательные фототропные реакции на синий свет. Как кончики корней, так и большинство кончиков стеблей проявляют положительный фототропизм к красному свету. [ необходима цитата ] Криптохромы — это фоторецепторы, которые поглощают синий/УФ-А свет, и они помогают контролировать циркадный ритм растений и время цветения. Фитохромы — это фоторецепторы, которые воспринимают красный/дальний красный свет, но они также поглощают синий свет; они могут контролировать цветение взрослых растений и прорастание семян, среди прочего. Сочетание реакций фитохромов и криптохромов позволяет растению реагировать на различные виды света. [16] Фитохромы и криптохромы вместе подавляют гравитропизм в гипокотилях и способствуют фототропизму. [2]