Аргон — химический элемент ; его символ Ar , атомный номер 18. Он находится в 18-й группе периодической таблицы и является благородным газом . [9] Аргон — третий по распространенности газ в атмосфере Земли , его содержание составляет 0,934% (9340 ppmv ). Его более чем в два раза больше, чем водяного пара (в среднем около 4000 ppmv, но сильно варьируется), в 23 раза больше, чем углекислого газа (400 ppmv) и более чем в 500 раз больше, чем неона (18 ppmv). Аргон — самый распространенный благородный газ в земной коре , его содержание составляет 0,00015% земной коры.
Почти весь аргон в атмосфере Земли — это радиогенный аргон-40 , полученный в результате распада калия -40 в земной коре. Во Вселенной аргон-36 — самый распространенный изотоп аргона , поскольку он легче всего образуется в результате звездного нуклеосинтеза в сверхновых .
Название «аргон» происходит от греческого слова ἀργόν , средней формы единственного числа от ἀργός, что означает «ленивый» или «неактивный», как указание на тот факт, что элемент почти не подвергается химическим реакциям. Полный октет (восемь электронов) во внешней атомной оболочке делает аргон стабильным и устойчивым к связыванию с другими элементами. Его температура тройной точки 83,8058 К является определяющей фиксированной точкой в Международной шкале температур 1990 года .
Аргон извлекается в промышленности путем фракционной перегонки жидкого воздуха . Он в основном используется в качестве инертного защитного газа при сварке и других высокотемпературных промышленных процессах, где обычно нереакционноспособные вещества становятся реактивными; например, атмосфера аргона используется в графитовых электропечах для предотвращения возгорания графита. Он также используется в лампах накаливания и люминесцентных лампах , а также в других газоразрядных трубках. Он делает отличительный сине-зеленый газовый лазер . Он также используется в люминесцентных стартерах свечения.

Аргон имеет примерно такую же растворимость в воде, как кислород , и в 2,5 раза более растворим в воде, чем азот . Аргон бесцветен, не имеет запаха, не воспламеняется и нетоксичен в твердом, жидком или газообразном состоянии. [10] Аргон химически инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Хотя аргон является благородным газом , он может образовывать некоторые соединения в различных экстремальных условиях. Было продемонстрировано наличие фторгидрида аргона (HArF), соединения аргона с фтором и водородом , которое стабильно при температуре ниже 17 К (−256,1 °C; −429,1 °F). [11] [12] Хотя нейтральные химические соединения аргона в основном состоянии в настоящее время ограничены HArF, аргон может образовывать клатраты с водой, когда атомы аргона захватываются решеткой молекул воды. [13] Ионы , такие как ArH+
, и комплексы возбужденного состояния , такие как ArF, были продемонстрированы. Теоретический расчет предсказывает еще несколько соединений аргона , которые должны быть стабильными [14], но пока не синтезированы.

Аргон ( греч. ἀργόν , средняя форма единственного числа от ἀργός, что означает «ленивый» или «неактивный») назван в честь его химической неактивности. Это химическое свойство этого первого открытого благородного газа произвело впечатление на создателей названия. [15] [16] В 1785 году Генри Кавендиш предположил, что нереакционноспособный газ является компонентом воздуха. [17]
Аргон был впервые выделен из воздуха в 1894 году лордом Рэлеем и сэром Уильямом Рамзаем в Университетском колледже Лондона путем удаления кислорода , углекислого газа , воды и азота из образца чистого воздуха. [18] Сначала они добились этого, повторив эксперимент Генри Кавендиша . Они удерживали смесь атмосферного воздуха с дополнительным кислородом в перевернутой пробирке (A) над большим количеством разбавленного щелочного раствора (B), который в оригинальном эксперименте Кавендиша был гидроксидом калия, [17] и пропускали ток через провода, изолированные U-образными стеклянными трубками (CC), которые были запечатаны вокруг платиновых проволочных электродов, оставляя концы проводов (DD) открытыми для газа и изолированными от щелочного раствора. Дуга питалась от батареи из пяти элементов Гроува и катушки Румкорфа среднего размера. Щелочь поглощала оксиды азота, производимые дугой, а также углекислый газ. Они управляли дугой до тех пор, пока не стало заметно уменьшение объема газа в течение по крайней мере часа или двух, а спектральные линии азота исчезли при исследовании газа. Оставшийся кислород прореагировал со щелочным пирогаллатом, оставив после себя, по-видимому, нереактивный газ, который они назвали аргоном.

Прежде чем выделить газ, они определили, что азот, полученный из химических соединений, на 0,5% легче азота из атмосферы. Разница была незначительной, но она была достаточно важной, чтобы привлечь их внимание на многие месяцы. Они пришли к выводу, что в воздухе был еще один газ, смешанный с азотом. [19] Аргон также был обнаружен в 1882 году в ходе независимых исследований HF Newall и WN Hartley. [20] Каждый из них наблюдал новые линии в спектре излучения воздуха, которые не соответствовали известным элементам.
До 1957 года символом аргона был «A». Он был изменен на Ar после того, как Международный союз теоретической и прикладной химии опубликовал работу «Номенклатура неорганической химии» в 1957 году. [21]
Аргон составляет 0,934% по объему и 1,288% по массе атмосферы Земли . [22] Воздух является основным промышленным источником очищенных аргоновых продуктов. Аргон выделяется из воздуха путем фракционирования, чаще всего путем криогенной фракционной перегонки , процесса, который также производит очищенный азот , кислород , неон , криптон и ксенон . [23] Земная кора и морская вода содержат 1,2 ppm и 0,45 ppm аргона соответственно. [24]
Основные изотопы аргона, обнаруженные на Земле:40
Ар (99,6%),36
Ар (0,34%) и38
Ar (0,06%). Встречается в природе.40K , с периодом полураспада 1,25 × 109 лет, снижается до стабильного40
Ar (11,2%) путем электронного захвата или позитронной эмиссии , а также до стабильного40
Ca (88,8%) по бета-распаду . Эти свойства и соотношения используются для определения возраста горных пород методом датирования K–Ar . [24] [25]
В атмосфере Земли,39
Ar образуется в результате активности космических лучей , в первую очередь, путем захвата нейтронов40
Ar с последующим двухнейтронным излучением. В подземной среде он также производится путем захвата нейтронов39
K , за которым следует испускание протонов.37
Ar образуется в результате захвата нейтрона40
Ca сопровождается выбросом альфа-частиц в результате подземных ядерных взрывов . Период полураспада составляет 35 дней. [25]
Между местами в Солнечной системе изотопный состав аргона сильно различается. Где основным источником аргона является распад40
К в горных породах,40
Ar будет доминирующим изотопом, как и на Земле. Аргон, полученный непосредственно в результате звездного нуклеосинтеза, доминирует над нуклидом альфа-процесса36
Ar . Соответственно солнечный аргон содержит 84,6%36
Ar (согласно измерениям солнечного ветра ) [26] , а соотношение трех изотопов 36 Ar : 38 Ar : 40 Ar в атмосферах внешних планет составляет 8400 : 1600 : 1. [27] Это контрастирует с низкой распространенностью первичных 36
Содержание Ar в атмосфере Земли составляет всего 31,5 ppmv (= 9340 ppmv × 0,337%), что сопоставимо с содержанием неона (18,18 ppmv) на Земле и с межпланетными газами, измеренными зондами .
Атмосферы Марса , Меркурия и Титана (крупнейшего спутника Сатурна ) содержат аргон, преимущественно в виде40
Ар . [28]
Преобладание радиогенных 40
Ar является причиной того, что стандартный атомный вес земного аргона больше, чем у следующего элемента, калия , факт, который был загадочным, когда аргон был открыт. Менделеев расположил элементы в своей периодической таблице в порядке атомного веса, но инертность аргона предполагала размещение перед реактивным щелочным металлом . Генри Мозли позже решил эту проблему, показав, что периодическая таблица на самом деле упорядочена в порядке атомного номера (см. Историю периодической таблицы ).
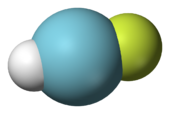
Полный октет электронов аргона указывает на полные s- и p-подоболочки. Эта полная валентная оболочка делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962 года аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. Первое соединение аргона с пентакарбонилом вольфрама, W(CO) 5Ar , было выделено в 1975 году. Однако в то время оно не было широко признано. [29] В августе 2000 года еще одно соединение аргона, фторгидрид аргона (HArF), было образовано исследователями из Хельсинкского университета путем облучения ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода с иодидом цезия . Это открытие привело к признанию того, что аргон может образовывать слабосвязанные соединения, хотя оно и не было первым. [12] [30] Он стабилен до 17 кельвинов (−256 °C). Метастабильный ArCF2+
2дикатион, который является валентно- изоэлектронным с карбонилфторидом и фосгеном , наблюдался в 2010 году. [31] Аргон-36 в форме ионов гидрида аргона ( аргония ) был обнаружен в межзвездной среде, связанной со сверхновой Крабовидной туманностью ; это была первая молекула благородного газа, обнаруженная в космическом пространстве . [32]
Твердый гидрид аргона (Ar(H 2 ) 2 ) имеет ту же кристаллическую структуру, что и фаза Лавеса MgZn 2 . Он образуется при давлениях от 4,3 до 220 ГПа, хотя измерения Рамана показывают, что молекулы H 2 в Ar(H 2 ) 2 диссоциируют выше 175 ГПа. [33]
Аргон добывается в промышленности путем фракционной перегонки жидкого воздуха в криогенной воздухоразделительной установке; процесс, который отделяет жидкий азот , кипятящий при 77,3 К, от аргона, кипятящего при 87,3 К, и жидкого кислорода , кипятящего при 90,2 К. Ежегодно во всем мире производится около 700 000 тонн аргона. [24] [34]

Аргон обладает рядом полезных свойств:
Другие благородные газы также подходят для большинства этих применений, но аргон, безусловно, самый дешевый. Он недорог, так как встречается в природе в воздухе и легко получается как побочный продукт криогенного разделения воздуха при производстве жидкого кислорода и жидкого азота : основные компоненты воздуха используются в больших промышленных масштабах. Другие благородные газы (кроме гелия ) также производятся таким образом, но аргон, безусловно, самый распространенный. Основная часть его применений возникает просто потому, что он инертен и относительно дешев.
Аргон используется в некоторых высокотемпературных промышленных процессах, где обычно нереактивные вещества становятся реактивными. Например, атмосфера аргона используется в графитовых электропечах для предотвращения горения графита.
Для некоторых из этих процессов присутствие азота или кислорода может привести к дефектам внутри материала. Аргон используется в некоторых типах дуговой сварки, таких как газовая дуговая сварка металлическим электродом и газовая дуговая сварка вольфрамовым электродом , а также при обработке титана и других реактивных элементов. Атмосфера аргона также используется для выращивания кристаллов кремния и германия .
Аргон используется в птицеводстве для удушения птиц, либо для массового забоя после вспышек заболеваний, либо как более гуманный способ убоя, чем электрооглушение . Аргон плотнее воздуха и вытесняет кислород близко к земле во время удушения инертным газом . [35] Его нереактивная природа делает его пригодным для использования в пищевых продуктах, и поскольку он заменяет кислород в мертвой птице, аргон также увеличивает срок годности. [36]
Аргон иногда используется для тушения пожаров , когда ценное оборудование может быть повреждено водой или пеной. [37]
Жидкий аргон используется в качестве мишени для нейтринных экспериментов и прямых поисков темной материи . Взаимодействие между гипотетическими WIMP и ядром аргона производит сцинтилляционный свет, который обнаруживается фотоумножительными трубками . Двухфазные детекторы, содержащие аргоновый газ, используются для обнаружения ионизированных электронов, образующихся при рассеянии WIMP–ядра. Как и большинство других сжиженных благородных газов, аргон имеет высокий выход сцинтилляционного света (около 51 фотона/кэВ [38] ), прозрачен для собственного сцинтилляционного света и относительно легко очищается. По сравнению с ксеноном , аргон дешевле и имеет отчетливый временной профиль сцинтилляции, что позволяет разделять электронные отдачи от ядерных отдач. С другой стороны, его собственный фон бета-излучения больше из-за39
Загрязнение аргоном , если только не использовать аргон из подземных источников, который имеет гораздо меньшее39
Ar загрязнение. Большая часть аргона в атмосфере Земли была получена в результате захвата электронов долгоживущими40
К (40
К + е − →40
Ar + ν), присутствующий в природном калии в пределах Земли.39
Активность Ar в атмосфере поддерживается космогенным производством через реакцию выбивания40
Ар (н,2н)39
Ar и подобные реакции. Период полураспада39
Ar составляет всего 269 лет. В результате подземный Ar, защищенный скалой и водой, имеет гораздо меньше39
Ar загрязнение. [39] Детекторы темной материи, в настоящее время работающие с жидким аргоном, включают DarkSide , WArP , ArDM , microCLEAN и DEAP . Эксперименты с нейтрино включают ICARUS и MicroBooNE , оба из которых используют высокочистый жидкий аргон в камере проекции времени для мелкозернистой трехмерной визуализации нейтринных взаимодействий.
В Университете Линчёпинга, Швеция, инертный газ используется в вакуумной камере, в которую вводится плазма для ионизации металлических пленок. [40] Этот процесс приводит к получению пленки, пригодной для производства компьютерных процессоров. Новый процесс устранит необходимость в химических ваннах и использовании дорогих, опасных и редких материалов.

Аргон используется для вытеснения содержащего кислород и влагу воздуха в упаковочном материале для продления срока годности содержимого (аргон имеет европейский код пищевой добавки E938). Воздушное окисление, гидролиз и другие химические реакции, которые разрушают продукты, замедляются или полностью предотвращаются. Высокочистые химикаты и фармацевтические препараты иногда упаковываются и запечатываются в аргоне. [41]
В виноделии аргон используется в различных целях для создания барьера против кислорода на поверхности жидкости, который может испортить вино, стимулируя как микробный метаболизм (например, уксуснокислые бактерии ), так и стандартную окислительно-восстановительную химию.
Аргон иногда используется в качестве пропеллента в аэрозольных баллончиках.
Аргон также используется в качестве консерванта для таких продуктов, как лак , полиуретан и краска, путем вытеснения воздуха для подготовки контейнера к хранению. [42]
С 2002 года Американский национальный архив хранит важные национальные документы, такие как Декларация независимости и Конституция, в заполненных аргоном ящиках, чтобы предотвратить их деградацию. Аргон предпочтительнее гелия, который использовался в предыдущие пять десятилетий, поскольку гелий выходит через межмолекулярные поры в большинстве контейнеров и должен регулярно заменяться. [43]

Аргон может использоваться в качестве инертного газа в линиях Шленка и перчаточных боксах . Аргон предпочтительнее менее дорогого азота в случаях, когда азот может реагировать с реагентами или аппаратурой.
Аргон может использоваться в качестве газа-носителя в газовой хроматографии и в масс-спектрометрии с электрораспылительной ионизацией ; это газ выбора для плазмы, используемой в спектроскопии ICP . Аргон предпочтителен для покрытия образцов распылением для сканирующей электронной микроскопии . Газ аргон также широко используется для осаждения распылением тонких пленок, как в микроэлектронике , и для очистки пластин в микропроизводстве .
Криохирургические процедуры, такие как криоабляция, используют жидкий аргон для разрушения тканей, таких как раковые клетки. Он используется в процедуре, называемой «аргон-усиленная коагуляция», форме электрохирургии аргонно -плазменным пучком . Процедура несет риск возникновения газовой эмболии и привела к смерти по крайней мере одного пациента. [44]
Синие аргоновые лазеры используются в хирургии для сварки артерий, разрушения опухолей и исправления дефектов глаз. [24]
Аргон также использовался экспериментально для замены азота в дыхательной или декомпрессионной смеси, известной как Argox , для ускорения выведения растворенного азота из крови. [45]

Лампы накаливания заполнены аргоном, чтобы предохранить нити накаливания от окисления при высокой температуре. [46] Он используется для специфического способа ионизации и излучения света, например, в плазменных шарах и калориметрии в экспериментальной физике элементарных частиц . Газоразрядные лампы, заполненные чистым аргоном, дают сиреневый/фиолетовый свет; с аргоном и некоторым количеством ртути — синий свет. Аргон также используется для синих и зеленых аргон-ионных лазеров .
Аргон используется для теплоизоляции в энергосберегающих окнах . [47] Аргон также используется в техническом подводном плавании для надувания сухого костюма , поскольку он инертен и имеет низкую теплопроводность. [48]
Аргон используется в качестве топлива при разработке ракеты с переменным удельным импульсом магнитоплазмы (VASIMR). Сжатый аргоновый газ расширяется, чтобы охлаждать головки самонаведения некоторых версий ракеты AIM-9 Sidewinder и других ракет, которые используют охлаждаемые тепловые головки самонаведения. Газ хранится под высоким давлением . [49]
Аргон-39, с периодом полураспада 269 лет, использовался для ряда приложений, в первую очередь для датирования ледяных кернов и грунтовых вод . Кроме того, датирование калием-аргоном и связанное с ним аргон-аргоновое датирование используются для датирования осадочных , метаморфических и магматических пород . [24]
Аргон использовался спортсменами в качестве допингового агента для имитации гипоксических состояний. В 2014 году Всемирное антидопинговое агентство (WADA) добавило аргон и ксенон в список запрещенных веществ и методов, хотя на данный момент нет надежного теста на злоупотребление. [50]
Хотя аргон нетоксичен, он на 38% плотнее воздуха и поэтому считается опасным удушающим веществом в закрытых помещениях. Его трудно обнаружить, поскольку он бесцветен, не имеет запаха и вкуса. Инцидент 1994 года, когда мужчина задохнулся после входа в заполненный аргоном участок строящейся нефтяной трубы на Аляске , подчеркивает опасность утечки аргонового резервуара в замкнутых пространствах и подчеркивает необходимость правильного использования, хранения и обращения. [51]
{{cite web}}: CS1 maint: неподходящий URL ( ссылка ){{cite journal}}: CS1 maint: неподходящий URL ( ссылка ){{cite web}}: CS1 maint: числовые имена: список авторов ( ссылка )