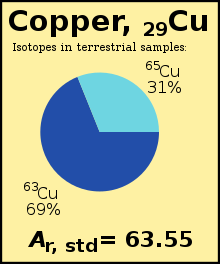
Стандартный атомный вес химического элемента (символ A r ° (E) для элемента «E») — это среднее арифметическое взвешенное относительных изотопных масс всех изотопов этого элемента , взвешенных по распространенности каждого изотопа на Земле . Например, изотоп 63 Cu ( Ar = 62,929) составляет 69% меди на Земле, а остальное составляет 65 Cu ( Ar = 64,927 ), поэтому
Поскольку относительные изотопные массы являются безразмерными величинами , это средневзвешенное значение также безразмерно. Ее можно преобразовать в меру массы (с размерностью M ), умножив ее на дальтон , также известный как константа атомной массы.
Среди различных вариантов понятия атомной массы ( Ar , также известной как относительная атомная масса ) , используемых учеными, стандартный атомный вес ( Ar °) является наиболее распространенным и практичным . Стандартный атомный вес каждого химического элемента определяется и публикуется Комиссией по изотопному содержанию и атомному весу (CIAAW) Международного союза теоретической и прикладной химии (IUPAC) на основе природных, стабильных земных источников элемента. В определении указано использование образцов из многих репрезентативных источников с Земли, так что это значение можно широко использовать в качестве «атомного веса» веществ в том виде, в котором они встречаются в действительности, например, в фармацевтических препаратах и научных исследованиях. Нестандартизованный атомный вес элемента специфичен для источников и образцов, например, атомный вес углерода в конкретной кости из определенного археологического памятника. Стандартный атомный вес усредняет такие значения в диапазоне атомных весов , который химик мог бы ожидать получить из множества случайных образцов с Земли. Этот диапазон является основанием для обозначения интервалов , данного для некоторых стандартных значений атомного веса.
Из 118 известных химических элементов 80 имеют стабильные изотопы, а 84 имеют ценность, обусловленную воздействием на окружающую среду Земли. Обычно такой величиной является, например, гелий: A r °(He) = 4,002 602 (2) . «(2)» указывает на неопределенность в последней показанной цифре, чтобы прочитать4,002 602 ± 0,000 002 . ИЮПАК также публикует сокращенные значения , округленные до пяти значащих цифр. Для гелия A r, сокращенно °(He) = 4.0026 .
Для четырнадцати элементов выборки расходятся по этому значению, поскольку их источники образцов имели разную историю распада. Например, таллий (Tl) в осадочных породах имеет другой изотопный состав, чем в магматических породах и вулканических газах. Для этих элементов стандартный атомный вес отмечается в виде интервала: A r °(Tl) = [204,38, 204,39] . С таким интервалом для менее требовательных ситуаций IUPAC также публикует условное значение . Для таллия А r условная °(Tl) = 204.38 .

Стандартный атомный вес — это особое значение относительной атомной массы . Он определяется как «рекомендуемые значения» относительных атомных масс источников в местной среде земной коры и атмосферы , определенные Комиссией ИЮПАК по атомному весу и содержанию изотопов (CIAAW). [2] В целом, значения из разных источников подвержены естественным изменениям из-за разной радиоактивной истории источников. Таким образом, стандартные атомные веса представляют собой ожидаемый диапазон атомных весов из диапазона образцов или источников. Ограничивая источники только земным происхождением, значения, определенные CIAAW, имеют меньшую дисперсию и являются более точным значением относительных атомных масс (атомных весов), фактически обнаруженных и используемых в мировых материалах.
Значения, опубликованные CIAAW, используются , а иногда и требуются по закону при массовых расчетах. Значения имеют неопределенность (отмечена в скобках) или представляют собой интервал ожидания (см. пример на рисунке выше). Эта неопределенность отражает естественную изменчивость распределения изотопов элемента, а не неопределенность измерений (которая намного меньше при использовании качественных инструментов). [3]
Хотя существует попытка охватить диапазон изменчивости на Земле стандартными значениями атомного веса, известны случаи образцов минералов, которые содержат элементы с атомными весами, выходящими за пределы стандартного диапазона атомных весов. [2]
Для синтетических элементов образование изотопа зависит от способа синтеза, поэтому концепция распространенности природных изотопов не имеет смысла. Поэтому для синтетических элементов общее количество нуклонов наиболее стабильного изотопа (т.е. изотопа с самым длинным периодом полураспада) указано в скобках вместо стандартного атомного веса.
Когда в химии используется термин «атомный вес», обычно подразумевается более конкретный стандартный атомный вес. Именно стандартные атомные массы используются в таблицах Менделеева и во многих стандартных справочниках в обычной земной химии.
Литий представляет собой уникальный случай, когда в некоторых случаях было обнаружено, что естественное содержание изотопов было нарушено деятельностью человека по разделению изотопов до такой степени, что это повлияло на неопределенность его стандартного атомного веса даже в образцах, полученных из природных источников, таких как реки. [ нужна ссылка ] [ сомнительно ]
Примером того, почему при указании стандартных значений атомного веса необходимо указывать «обычные наземные источники», является элемент аргон. В разных местах Солнечной системы атомный вес аргона варьируется на целых 10% из-за значительных различий в изотопном составе. Если основным источником аргона является распад40К в скалах,40
Ar будет доминирующим изотопом. К таким местам относятся планеты Меркурий и Марс, а также луна Титан. На Земле соотношение трех изотопов 36 Ar: 38 Ar: 40 Ar составляет примерно 5:1:1600, что дает земному аргону стандартный атомный вес 39,948(1).
Однако в остальной части Вселенной дело обстоит иначе. В аргоне, производимом непосредственно в результате звездного нуклеосинтеза , преобладает нуклид альфа-процесса.36
Ар . Соответственно, солнечный аргон содержит 84,6%36
Ar (по измерениям солнечного ветра ) [4] , а соотношение трех изотопов 36 Ar : 38 Ar : 40 Ar в атмосферах внешних планет составляет 8400 : 1600 : 1. [5] Атомный вес аргона в Следовательно, Солнце и большая часть Вселенной будут иметь лишь приблизительно 36,3. [6]
Как известно, опубликованное значение атомного веса имеет неопределенность. Эта неопределенность (и связанная с ней точность) следует из ее определения, согласно которому источник является «земным и стабильным». Систематическими причинами неопределенности являются:
Эти три неопределенности накапливаются. Опубликованная стоимость является результатом всего этого.
Современные относительные атомные массы (термин, характерный для данного образца элемента) рассчитываются на основе измеренных значений атомной массы (для каждого нуклида) и изотопного состава образца. Высокоточные атомные массы доступны [7] [8] практически для всех нерадиоактивных нуклидов, но изотопные составы сложнее измерить с высокой точностью и они более подвержены различиям между образцами. [9] [10] По этой причине относительные атомные массы 22 мононуклидных элементов (которые такие же, как изотопные массы для каждого из отдельных встречающихся в природе нуклидов этих элементов) известны с особенно высокой точностью.
Расчет приведен на примере кремния , относительная атомная масса которого особенно важна в метрологии . Кремний существует в природе в виде смеси трех изотопов: 28 Si, 29 Si и 30 Si. Атомные массы этих нуклидов известны с точностью до одной миллиардной для 28 Si и примерно до одной миллиардной для остальных. Однако диапазон естественного содержания изотопов таков, что стандартное содержание можно определить только с точностью до ±0,001% (см. Таблицу). Расчет
Оценка неопределенности сложна , [11] особенно потому, что распределение выборки не обязательно симметрично: стандартные относительные атомные массы ИЮПАК указаны с расчетными симметричными неопределенностями, [12] , а значение для кремния составляет 28,0855(3). Относительная стандартная неопределенность этой величины составляет 1 × 10 –5 или 10 ppm. Чтобы еще больше отразить эту естественную изменчивость, в 2010 году ИЮПАК принял решение перечислить относительные атомные массы 10 элементов в виде интервала, а не фиксированного числа. [13]
Использование названия «атомный вес» вызвало много споров среди ученых. [14] Противники этого названия обычно предпочитают термин « относительная атомная масса » (не путать с атомной массой ). Основное возражение состоит в том, что атомный вес не является весом , то есть силой , действующей на объект в гравитационном поле и измеряемой в таких единицах силы, как ньютон или паундаль . [ нужна цитата ]
В ответ сторонники термина «атомный вес» отмечают (среди прочих аргументов) [14], что:
Можно добавить, что атомный вес также часто не является истинно «атомным», поскольку он не соответствует свойству какого-либо отдельного атома. Тот же аргумент можно привести и против термина «относительная атомная масса», используемого в этом смысле.
ИЮПАК публикует одно формальное значение для каждого стабильного химического элемента , называемое стандартным атомным весом . [16] [1] : Таблица 1. Любые обновления публикуются два раза в год (в нечетные годы). В 2015 году был обновлен атомный вес иттербия. [16] В 2017 году было изменено 14 атомных весов, в том числе изменение атомного веса аргона с единичного числа на интервальное значение. [17] [18]
Опубликованное значение может иметь неопределенность, как для неона:20.1797(6) или может быть интервалом, как для бора: [10.806, 10.821].
Помимо этих 84 значений, ИЮПАК также публикует сокращенные значения (только до пяти цифр на число), а для двенадцати интервальных значений - обычные значения (одночисловые значения).
Символ A r представляет собой относительную атомную массу, например, из конкретного образца. Точнее, стандартный атомный вес можно обозначить как A r °(E) , где (E) — символ элемента.
Сокращенный атомный вес , также опубликованный CIAAW, получен из стандартного атомного веса, сокращая числа до пяти цифр (пяти значащих цифр). В названии не сказано «округленный».
Границы интервалов округляются вниз для первой (самой нижней) границы и вверх для верхней (самой верхней) границы. Таким образом, полностью покрывается более точный исходный интервал. [1] : Таблица 2
Примеры:
Четырнадцать химических элементов – водород, литий, бор, углерод, азот, кислород, магний, кремний, сера, хлор, аргон, бром, таллий и свинец – имеют стандартный атомный вес, который определяется не одним числом, а числом. интервал. Например, у водорода A r °(H) = [1,00 784, 1,00811] . В этих обозначениях говорится, что различные источники на Земле имеют существенно разные изотопные составы и что неопределенности во всех них просто покрываются двумя числами. Для этих элементов не существует «среднего земного» состава, и «правильное» значение не является его серединой (которое для водорода было бы 1,007975, с неопределенностью (± 0,000135), которая заставляла бы его просто покрывать интервал). Однако для ситуаций, когда менее точное значение приемлемо, например, в торговле, CIAAW опубликовал однозначный условный атомный вес . Для водорода A r условное °(H) = 1,008 . [1] : Таблица 3
Используя сокращенное значение и обычное значение для четырнадцати интервальных значений, для всех стабильных элементов можно указать короткое значение, определенное IUPAC (5 цифр плюс неопределенность). Во многих ситуациях и в таблицах Менделеева это может быть достаточно подробно. [1] : Таблицы 2 и 3.
Об обозначениях и обработке неопределенностей в значениях, в том числе в значениях диапазона [ ]:
стандартные атомные массы: рекомендуемые значения относительных атомных масс элементов, пересматриваемые раз в два года Комиссией ИЮПАК по атомным весам и изотопному содержанию и применимые к элементам в любой нормальной пробе с высоким уровнем достоверности.
Обычный образец — это любой разумно возможный источник элемента или его соединений, используемый в промышленности и науке, и не подвергавшийся значительной модификации изотопного состава в течение геологически короткого периода.