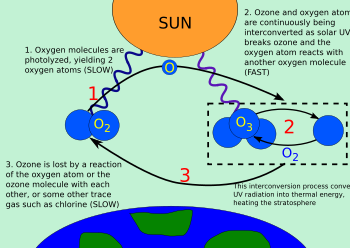
Озоно- кислородный цикл — это процесс, посредством которого озон непрерывно восстанавливается в стратосфере Земли , преобразуя ультрафиолетовое излучение ( УФ) в тепло . В 1930 году Сидней Чепмен разрешил химию этого процесса. Этот процесс обычно называют циклом Чепмена среди атмосферных ученых.
Большая часть производства озона происходит в тропической верхней стратосфере и мезосфере. Общая масса озона, производимого в день по всему земному шару, составляет около 400 миллионов метрических тонн. Глобальная масса озона относительно постоянна и составляет около 3 миллиардов метрических тонн, что означает, что Солнце производит около 12% озонового слоя каждый день. [1]
Цикл Чепмена описывает основные реакции, которые естественным образом определяют, в первом приближении, концентрацию озона в стратосфере. Он включает четыре процесса - и пятый, менее важный - все с участием атомов и молекул кислорода, а также ультрафиолетового излучения: [2]
Молекула кислорода расщепляется ( фотолизируется ) под действием ультрафиолетового света более высокой частоты (верхний предел УФ-В , УФ-С и выше) на два атома кислорода (см. рисунок):
Каждый атом кислорода может затем соединиться с молекулой кислорода, образовав молекулу озона:
Молекулы озона, образованные в результате реакции (выше), поглощают излучение с соответствующей длиной волны между УФ-С и УФ-В . Трехатомная молекула озона становится двухатомным молекулярным кислородом, плюс свободный атом кислорода (см. рисунок):
Образующийся атомарный кислород может реагировать с другой молекулой кислорода, образуя озон посредством реакции образования озона (реакция 2 выше).
Таким образом, эти две реакции образуют озоно-кислородный цикл, в котором химическая энергия, высвобождаемая при создании озона, становится молекулярной кинетической энергией. Конечным результатом цикла является преобразование проникающего УФ-В-излучения в тепло без какой-либо чистой потери озона. Поддерживая озоновый слой в стабильном равновесии и защищая нижнюю атмосферу от вредного УФ-излучения, цикл также обеспечивает один из двух основных источников тепла в стратосфере (другой — кинетическая энергия, высвобождаемая при фотолизе O 2 в отдельные атомы O).
Если встречаются атом кислорода и молекула озона, они рекомбинируют, образуя две молекулы кислорода:
Два атома кислорода могут реагировать, образуя одну молекулу кислорода:
Обратите внимание, что реакция 5 имеет наименьшее значение в стратосфере, поскольку при нормальных условиях концентрация атомов кислорода намного ниже, чем двухатомных молекул кислорода. Поэтому эта реакция встречается реже, чем образование озона (реакция 2).
Общее количество озона в стратосфере определяется балансом между образованием из солнечной радиации и его удалением. Скорость удаления медленная, поскольку концентрация свободных атомов O очень низкая.
Помимо этих пяти реакций, некоторые свободные радикалы , наиболее важными из которых являются гидроксил (OH), оксид азота (NO), а также атомарный хлор (Cl) и бром (Br), катализируют реакцию рекомбинации , что приводит к образованию озонового слоя, который тоньше, чем он был бы при отсутствии катализаторов.
Большинство OH и NO естественным образом присутствуют в стратосфере, но деятельность человека — особенно выбросы хлорфторуглеродов ( ХФУ ) и галонов — значительно увеличила концентрацию Cl и Br, что привело к истощению озонового слоя . Каждый атом Cl или Br может катализировать десятки тысяч реакций разложения, прежде чем он будет удален из стратосферы.
Для заданных относительных концентраций реагентов скорости образования озона и рекомбинации кислорода (реакции 2 и 5) пропорциональны кубу плотности воздуха, в то время как скорость преобразования озона (реакция 4) пропорциональна квадрату плотности воздуха, а реакции фотодиссоциации (реакции 1 и 3) имеют линейную зависимость от плотности воздуха. Таким образом, в верхней термосфере, где плотность воздуха очень низкая, а поток фотонов высок, фотодиссоциация кислорода происходит быстро, в то время как образование озона низкое, поэтому его концентрация низкая. Таким образом, наиболее важными реакциями являются фотодиссоциация кислорода и рекомбинация кислорода, при этом большая часть молекул кислорода диссоциирует на атомы кислорода. [3]
По мере того, как мы спускаемся в нижнюю термосферу (например, на высоту 100 км и ниже), поток фотонов в длинах волн <170 нм резко падает из-за поглощения кислородом в реакции фотодиссоциации кислорода (реакция 1). Этот режим длины волны имеет самое высокое поперечное сечение для этой реакции (10-17 см2 на молекулу кислорода), и, таким образом, скорость фотодиссоциации кислорода на молекулу кислорода значительно уменьшается на этих высотах, с более чем 10-7 в секунду (примерно раз в месяц) на 100 км до 10-8 в секунду (примерно раз в несколько лет) на 80 км. [4] В результате концентрация атомарного кислорода (как относительная, так и абсолютная) резко уменьшается, и продолжается образование озона (реакция 2), что приводит к небольшому, но не пренебрежимо малому присутствию озона. [5]
Обратите внимание, что температура также падает с уменьшением высоты, поскольку более низкие скорости фотодиссоциации фотонов означают более низкое производство тепла на молекулу воздуха.
Нечетные формы кислорода (атомарный кислород и озон) имеют чистую скорость создания только за счет диссоциации кислорода (реакция 1), и чистое разрушение либо за счет конверсии озона, либо за счет рекомбинации кислорода (реакции 4 и 5). В стационарном состоянии эти процессы сбалансированы, поэтому скорости этих реакций подчиняются:
В устойчивом состоянии образование озона также уравновешивается его удалением. Таким образом:
Из этого следует, что:
Правая часть — это общая скорость фотодиссоциации кислорода или озона.
Ниже термосферы концентрация атомарного кислорода очень мала по сравнению с молекулярным кислородом. [6] Поэтому атомы кислорода с гораздо большей вероятностью будут сталкиваться с молекулами кислорода (двухатомными), чем с другими атомами кислорода, что делает рекомбинацию кислорода (реакция 5) гораздо более редкой, чем образование озона (реакция 2). Следуя стационарному соотношению между скоростями реакций, мы можем поэтому аппроксимировать: [7]
В мезосфере фотодиссоциация кислорода преобладает над фотодиссоциацией озона, поэтому имеем приблизительно: [4]
Таким образом, озон в основном удаляется путем преобразования озона. Как создание озона, так и преобразование линейно зависят от концентрации атомов кислорода, но при создании озона атом кислорода должен одновременно столкнуться с молекулой кислорода и другой молекулой воздуха (обычно азота), тогда как при преобразовании озона атом кислорода должен столкнуться только с молекулой озона. Таким образом, когда обе реакции сбалансированы, соотношение между концентрациями озона и молекулярного кислорода приблизительно пропорционально плотности воздуха.
Поэтому относительная концентрация озона выше на более низких высотах, где плотность воздуха выше. Эта тенденция продолжается в некоторой степени ниже в стратосфере, и, таким образом, по мере продвижения от высоты 60 км до 30 км, как плотность воздуха, так и относительная концентрация озона увеличиваются примерно в 40-50 раз. [8] [9] [10]
Поглощение кислородом в мезосфере и термосфере (в реакции фотодиссоциации кислорода) уменьшает поток фотонов на длинах волн ниже 200 нанометров, где в фотодиссоциации кислорода доминируют полосы Шумана-Рунге и континуум с поперечным сечением до 10 -17 см 2 . Из-за этого поглощения поток фотонов на этих длинах волн настолько мал в стратосфере, что фотодиссоциация кислорода становится доминирующей полосой Герцберга с длиной волны фотона 200-240 нм, хотя сечение этого процесса составляет всего 10 -24 - 10 -23 см 2 . Скорость фотодиссоциации озона на молекулу озона имеет поперечное сечение на 6 порядков выше в диапазоне длин волн 220-300 нм. При концентрации озона порядка 10-6 -10-5 относительно молекулярного кислорода фотодиссоциация озона становится доминирующей реакцией фотодиссоциации, и большая часть тепла в стратосфере генерируется посредством этого процесса, с самой высокой скоростью генерации тепла на молекулу на верхней границе стратосферы ( стратопаузе ) , где концентрация озона уже относительно высока, а поток УФ-излучения в этих длинах волн все еще высок, прежде чем он будет истощен этим же процессом фотодиссоциации.
В дополнение к тому, что фотодиссоциация озона становится все более доминирующей реакцией удаления, каталитическое разрушение озона из-за свободных радикалов (в основном атомарного водорода , гидроксила , оксида азота , хлора и бромида ) увеличивает эффективную скорость реакции преобразования озона. Оба процесса способствуют увеличению удаления озона, что приводит к более умеренному увеличению относительной концентрации озона по мере уменьшения высоты, хотя плотность воздуха продолжает увеличиваться. [4]
Из-за того, что плотность озона и кислорода растет по мере того, как мы спускаемся на более низкие высоты, поток УФ-фотонов на длинах волн ниже 300 нм существенно уменьшается, а скорость фотодиссоциации кислорода падает ниже 10 -9 в секунду на молекулу на высоте 30 км. [4] С уменьшением скорости фотодиссоциации кислорода нечетные виды кислорода (атомарный кислород и молекулы озона) почти не образуются de novo (а не преобразуются друг в друга другими реакциями), и большая часть атомарного кислорода, необходимого для создания озона, получается почти исключительно из удаления озона путем фотодиссоциации озона. Таким образом, озон истощается по мере того, как мы спускаемся ниже высоты 30 км и достигает очень низких концентраций в тропопаузе . [8]
В тропосфере образование и разрушение озона больше не контролируются озоно-кислородным циклом. Скорее, химия тропосферного озона сегодня доминирует за счет промышленных загрязнителей и других газов вулканического происхождения. [4]