[NiFe] гидрогеназа — это тип гидрогеназы , окислительного фермента , который обратимо преобразует молекулярный водород в прокариотах , включая бактерии и археи . [1] [2] Каталитический участок фермента обеспечивает простые микроорганизмы, метаболизирующие водород, окислительно-восстановительным механизмом, с помощью которого можно хранить и использовать энергию посредством реакции.
Это особенно важно для анаэробных сульфатредуцирующих бактерий рода Desulfovibrio [3] [4] , а также патогенных организмов Escherichia coli и Helicobacter pylori [2] . Механизмы, созревание и функции гидрогеназ [NiFe] активно исследуются для применения в водородной экономике и в качестве потенциальных мишеней для антибиотиков.

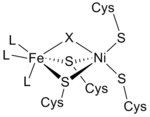
Структура [NiFe] гидрогеназы была получена в результате рентгеновских кристаллографических исследований пяти различных сульфатредуцирующих бактерий: Desulfovibrio vulgaris Miyazaki F, [6] D. gigas , [7] D. frutosovorans , [8] [9] D. desulfuricans, [10] и Desulfomicrobium baculatum . [11] [NiFe] гидрогеназа, выделенная из D. vulgaris Miyazaki F, показана справа. Более крупная субъединица выделена синим цветом, имеет молекулярную массу 62,5 кДа и содержит активный центр Ni-Fe . Меньшая субъединица выделена пурпурным цветом, имеет молекулярную массу 28,8 кДа и содержит кластеры Fe-S .
Из инфракрасных спектров и рентгеновской кристаллографии было обнаружено, что активный центр гидрогеназы [NiFe] представляет собой (S-Cys) 4 Ni(μ-X)Fe(CO)(CN) 2 , в котором общий лиганд X представляет собой либо оксид , серу , гидропероксид , либо гидроксид, находящиеся только в окисленном состоянии. [12] В то время как атом никеля участвует в окислительно-восстановительных реакциях, атом железа постоянно находится в состоянии окисления Fe(II). [12] Точная геометрия трех небелковых лигандов (обозначаемых как L), координирующихся с ионом Fe, неизвестна; однако они были идентифицированы как одна молекула оксида углерода (C≡O) и две молекулы цианида ( − C≡N). [13]
Почти все гидрогеназы содержат по крайней мере один кластер железа и серы (кластер Fe-S). Как упоминалось ранее, эти кластеры Fe-S соединяют активный центр фермента никеля с поверхностью белка, поскольку они служат в качестве цепи переноса электронов от окислительно-восстановительного центра Ni-Fe к акцептору электронов цитохрому c 3 (см. семейство цитохромов c ). [13] Эти электроны производятся в результате гетеролитического расщепления молекулы водорода в активном центре Ni-Fe. Кристаллические структуры гидрогеназы показывают Fe 3 S 4 в центре цепи и кластер Fe 4 S 4 на молекулярной поверхности. Расстояние между внутренним кластером Fe 4 S 4 и активным центром составляет приблизительно 12 Å. [13]
Гидрогеназы [NiFe] и [NiFeSe] имеют удивительно схожие структуры, что приводит к предположению, что один атом серы в кластере Fe-S был заменен атомом селена , но эти гидрогеназы различаются по каталитической активности и чувствительности к ингибиторам ферментов . [4]

[NiFe] гидрогеназа имеет катион Mg2 + , связанный в области C-конца большей субъединицы. Этот катион связан с тремя молекулами воды и тремя аминокислотами , и он стабилизирует эту свободную от растворителя область. На расстоянии примерно 13 Å от фрагмента [NiFe] этот катион соединяет активный сайт с сетью водородных связей и служит в качестве пути переноса протона (H + ). [13]
Исследования, в которых ксенон был связан с гидрогеназой, предполагают наличие гидрофобного газового канала, через который газы H 2 , CO и O 2 могли достигать глубоко зарытого активного центра внутри фермента. Кристаллическая структура выявила несколько небольших каналов на поверхности, которые объединились в один более крупный канал, достигший активного центра [Ni-Fe]. [13]
Поскольку хорошо известно, что гидрогеназы чувствительны к кислороду , диффузия газа к активному центру зависит от размера и окружения канала доступа газа, реакции молекулярного кислорода (O 2 ) в активном центре и восстановления активного центра после окисления. [13]
Точный механизм реакции гидрогеназ [NiFe] был предметом больших споров. В 2009 году Хигучи и его коллеги предложили механизм, основанный на рентгеновской кристаллографии и спектроскопических данных Desulfovibrio vulgaris Miyazaki F. [13] В ходе каталитического процесса ион Fe в активном центре не меняет своего состояния окисления , в то время как ион металла Ni участвует в окислительно-восстановительной химии. Существует две основные группы окислительно-восстановительных состояний, через которые проходят гидрогеназы [NiFe] во время катализа:
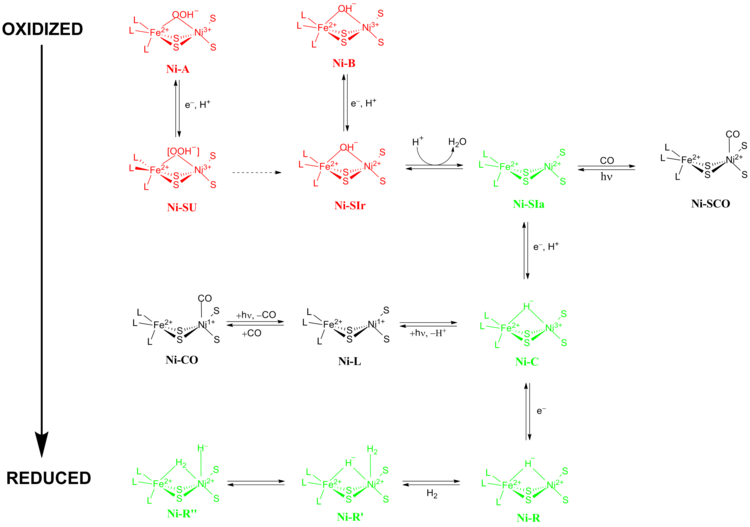
Ni-A (состояние «неготовности») и Ni-B (состояние «готовности») являются наиболее окисленными формами металлического центра [NiFe] и активируются посредством одноэлектронного восстановления с переносом протона. Скорость восстановительной активации Ni-A в Ni-SU может занять часы, в то время как скорость восстановительной активации Ni-B в Ni-SIr происходит за секунды. [14] Было высказано предположение , что причиной этого несоответствия в кинетике активации между Ni-A и Ni-B является разница в мостиковых лигандах между двумя различными окислительно-восстановительными состояниями. В состоянии Ni-SIr высвобождается молекула воды, образуя состояние Ni-SIa , первое каталитическое окислительно-восстановительное активное состояние гидрогеназ [NiFe].
Три наиболее важных каталитических окислительно-восстановительных активных состояния гидрогеназ [NiFe] — это Ni-SIa , Ni-C и Ni-R (которые имеют три различных варианта). [13] Чувствительное к свету состояние Ni-C может быть получено путем одноэлектронного восстановления Ni-SIa . Спектроскопические исследования электронного парамагнитного резонанса состояния Ni-C , которое содержало Ni 3+ с S = 1/2 и гидрид, соединяющий два металла, Ni и Fe, показали, что гетеролитическое расщепление H 2 происходит в активном центре гидрогеназы [NiFe].
Состояние Ni-SIa может быть ингибировано CO, который напрямую связывается с ионом металла Ni в изогнутой конформации, образуя Ni-SCO (см. ниже). [15] Поскольку Ni-C чувствителен к свету, освещение при 100 К приводит к окислительно-восстановительному состоянию Ni-L . В ходе этого процесса никель восстанавливается. В присутствии CO Ni-L образует состояние Ni-CO .

Созревание гидрогеназ [NiFe] требует набора вспомогательных белков, которые синтезируют активный центр NiFe и модифицируют фермент-предшественник таким образом, чтобы он имел правильную структуру и местоположение. [2] [16] [17] Созревание активного центра представляет особый интерес из-за синтеза металлических лигандов цианида (CN) и оксида углерода (CO), которые обычно токсичны для живых организмов. [16] Этот этап завершается белками HypC, HypD, HypE и HypF. [17 ] [18] После синтеза железного центра никель вставляется с использованием металлошаперонов HypA, HypB и SlyD. [ 17] [18] После завершения каталитического центра предшественник гидрогеназы подвергается расщеплению С-конца, что вызывает перестройку его структуры и ассоциацию с малой субъединицей. [16] [17] [18] Наконец, готовый фермент транспортируется в правильное положение внутри клетки. [16] [17] [18] Промотор гидрогеназы, P SH , можно изучить, сконструировав слияние промотора P SH- gfp с использованием репортерного гена зеленого флуоресцентного белка ( gfp) . [19]
Поскольку [NiFe] гидрогеназа является членом семейства гидрогеназ , эти ферменты могут катализировать как потребление, так и производство водорода. [1] Изучая [NiFe] гидрогеназу, ученые могут оптимизировать состояние, в котором белок будет производить только водород. Кроме того, небольшой фермент, имитирующий [NiFe] гидрогеназу, также может быть синтезирован для работы в качестве генератора газообразного водорода. Растворимая [NiFe] гидрогеназа из Ralstonia eutropha H16 является перспективным кандидатом на фермент для применения в биотопливе на основе H2 , поскольку она способствует окислению H2 и относительно устойчива к кислороду. Ее можно производить на гетеротрофных средах для роста [20] и очищать с помощью матриц анионообменной и эксклюзионной хроматографии . [21]