

Диссоциация с переносом электронов ( ETD ) — это метод фрагментации многозарядных газообразных макромолекул в масс-спектрометре между этапами тандемной масс-спектрометрии (MS/MS). [1] Подобно диссоциации с захватом электронов , ETD вызывает фрагментацию больших многозарядных катионов путем передачи им электронов . [2] ETD широко используется с полимерами и биологическими молекулами, такими как белки и пептиды, для анализа последовательностей . [3] Передача электрона вызывает расщепление пептидной цепи на c- и z-ионы , оставляя лабильные посттрансляционные модификации (PTM) нетронутыми. [4] Этот метод хорошо работает только для пептидов или полимерных ионов с более высоким зарядом (z>2). [2] Однако по сравнению с диссоциацией, вызванной столкновениями (CID), ETD выгоден для фрагментации более длинных пептидов или даже целых белков. [5] Это делает этот метод важным для нисходящей протеомики . Метод был разработан Хантом и его коллегами в Университете Вирджинии . [6]
Диссоциация с захватом электронов (ECD) была разработана в 1998 году для фрагментации крупных белков для масс-спектрометрического анализа. [7] Поскольку ECD требует большого количества электронов, близких к тепловым (<0,2 эВ), первоначально он использовался исключительно с масс-спектрометрией ионного циклотронного резонанса с преобразованием Фурье (FTICR), самой дорогой формой масс-спектрометрического оборудования. [8] Менее дорогостоящие варианты, такие как приборы с квадрупольным временем пролета (Q-TOF), квадрупольной ионной ловушкой (QIT) и линейной квадрупольной ионной ловушкой (QLT), использовали более энергоемкий метод диссоциации, вызванной столкновениями (CID), что приводило к случайной фрагментации пептидов и белков. [9] В 2004 году Syka et al. объявили о создании ETD, метода диссоциации, похожего на ECD, но с использованием недорогого, широкодоступного коммерческого спектрометра. Первые эксперименты с ETD проводились на масс-спектрометре QLT с источником ионизации электрораспылением (ESI). [10]
В диссоциации переноса электронов задействовано несколько этапов. Обычно смесь белков сначала разделяется с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Затем многократно протонированные молекулы-предшественники генерируются с помощью электрораспылительной ионизации и вводятся в масс-спектрометр. (В ЭТД могут использоваться только молекулы с зарядом 2+ или выше.) Для того чтобы электрон был передан положительным молекулам-предшественникам, генерируются радикальные анионы и помещаются вместе с ними в ионную ловушку. Во время реакции ион/ион электрон передается положительно заряженному белку или пептиду, вызывая фрагментацию вдоль пептидной цепи. Наконец, полученные фрагменты подвергаются масс-анализу. [11]
В первоначальных экспериментах ETD антрацен (C 14 H 10 ) использовался для генерации реактивных радикальных анионов посредством отрицательной химической ионизации . [10] Несколько полициклических ароматических углеводородных молекул использовались в последующих экспериментах, причем в настоящее время предпочтительным реагентом является флуорантен . [12] Однако эффективность флуорантена в переносе электронов составляет всего около 40%, поэтому ведутся поиски других молекул с низким сродством к электрону. [11]

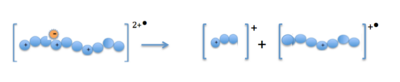
Когда катионы-предшественники (белки или пептиды) и радикальные анионы объединяются в ионной ловушке, электрон переносится на многозарядный катион. Это образует нестабильный положительный катион-радикал с одним меньшим положительным зарядом и нечетным электроном. [13] Фрагментация происходит вдоль пептидного остова по связи N− Cα, что приводит к образованию фрагментных ионов c- и z-типа. [14]
Фрагментация, вызванная ETD, позволяет получить более полную информацию о последовательности белка из спектров ETD, чем из тандемной масс-спектрометрии CID. Поскольку обнаруживается много ионов пептидного остова c- и z-типа, почти полное покрытие последовательностей многих пептидов может быть определено из спектров фрагментации ETD. [15] Последовательности из 15-40 аминокислот как на N-конце, так и на C-конце белка можно прочитать, используя значения массы к заряду для одно- и двухзарядных ионов. Эти последовательности вместе с измеренной массой интактного белка можно сравнить с записями в базе данных для известных белков и выявить посттрансляционные модификации. [16]

Диссоциация переноса электронов происходит в масс-спектрометре с ионной ловушкой с источником ионизации электрораспылением. Первые эксперименты ETD в Университете Вирджинии использовали радиочастотную квадрупольную линейную ионную ловушку (LQT), модифицированную источником химической ионизации (CI) на задней стороне прибора (см. схему справа). [10] Поскольку спектр может быть получен примерно за 300 миллисекунд, жидкостную хроматографию часто сочетают с ETD MS/MS. [11] Недостатком использования LQT является то, что разрешающая способность по массе меньше, чем у других масс-спектрометров. [14]
Последующие исследования пытались использовать другие приборы для улучшения разрешения по массе. Наличие отрицательного источника CI в задней части прибора мешало анализатору высокого разрешения в LQT-Orbitrap и квадрупольном времени пролета (QTOF), поэтому были введены альтернативные методы ионизации для радикальных анионов. [11]
В 2006 году группа в Университете Пердью под руководством Скотта Маклаки использовала квадрупольный/времяпролетный (QqTOF) тандемный масс-спектрометр с импульсным нано-ESI/химической ионизацией при атмосферном давлении (APCI) двойным источником ионизации, используя радикальные анионы 1,3-динитробензола в качестве донора электронов. [17] Позже лаборатория в Университете Висконсина адаптировала гибридный квадрупольный линейный ионный ловушка-орбитальный масс-спектрометр для использования ETD. Этот метод также использовал метод фронтальной ионизации для радикальных анионов 9-антраценкарбоновой кислоты с помощью импульсных двойных источников ESI. [18]
Поскольку метод ETD становится все более популярным для анализа структуры белков и пептидов, его внедрение на легкодоступных масс-спектрометрах с ионными ловушками в сочетании с масс-анализаторами высокого разрешения продолжает развиваться. [19]
ETD широко используется в анализе белков и крупных пептидов. Важные посттрансляционные модификации, включая фосфорилирование , гликозилирование и дисульфидные связи, анализируются с помощью ETD. [20]
Хотя анализы полимеров на основе MS в основном проводились с использованием одноступенчатой MS, тандемная MS также использовалась для характеристики полимерных компонентов. CID является наиболее распространенным методом диссоциации, но ETD использовался как дополнительный метод. Уникальные разрывы связей, возникающие в результате ETD, предоставляют ценную диагностическую информацию. [2]