Полный синтез таксола Кувадзима, выполненный группой Исао Кувадзимы из Токийского технологического института, является одной из нескольких попыток полного синтеза таксола, опубликованных в 1990 - х годах. [1] [2] Полный синтез таксола считается важной вехой в органическом синтезе .
Этот синтез является действительно синтетическим без какой-либо помощи со стороны малых биомолекулярных предшественников, а также линейным синтезом с конструкцией кольцевой молекулы в порядке A, B, C, D. В какой-то момент хиральность запирается в молекуле посредством асимметричного шага синтеза , который является уникальным по сравнению с другими попытками. Как и в других попытках, добавление хвоста основано на лактаме Одзима .
Каркас из 20 углеродных атомов состоит из нескольких частей: пропаргиловый спирт (C1, C2, C14), пропионовый альдегид (C13, C12, C18), изомасляная кислота (C15, C16, C17, C11), триметил(фенилтиометил)силан (C10), 2-бромбензальдегид (C3–C9), диэтилалюминийцианид (C19) и триметилсилилметилбромид (C20).
Синтез кольца A ( схема 1 ) начался с присоединения защищенного THP пропаргилового спирта 1.1 (фрагмент C2-C1-C14) и пропионового альдегида 1.2 (фрагмент C13-C12-C18) в нуклеофильном присоединении с н -бутиллитием к спирту 1.3 . Затем катализатор Линдлара восстановил алкин до алкена в 1.4 , а окисление Сверна превратило спиртовую группу в еноновую группу в 1.5 . Затем фрагмент C11-C15-C16-C17 1.6 был добавлен в качестве литиевого енолята этилового эфира изомасляной кислоты в сопряженном присоединении к гамма -кетоэфиру 1.7 . Конденсация Клайзена замкнула кольцо до 1.8, и промежуточный енол был захвачен пивалоилхлоридом (piv) в качестве защитной группы . Группа THP была удалена с помощью TsOH до 1.9 , а образовавшийся спирт окислился окислением по Сверну до альдегида 1.10 . Силиловый еноловый эфир TIPS 1.11 был образован в результате реакции с трифлатом TIPSOtf и DBU в DMAP, что создало условия для асимметричного дигидроксилирования до гидроксиальдегида 1.12 . Затем защитная группа piv была заменена группой TIPS в 1.14 после защиты альдегида в виде аминаля 1.13 , и поскольку эта группа автоматически теряется при колоночной хроматографии , шаг был повторен до аминаля 1.15. Затем фрагмент C10 был введен литиевой солью триметил(фенилтиометил)силана 1.16 в олефинировании Петерсона до сульфида 1.17 с последующим снятием защиты до полного кольца A 1.18 . Кольцо A теперь завершено с альдегидной группой и десульфидной группой на месте для закрепления с кольцом C, образуя кольцо B.
Нижняя часть кольца B была построена путем нуклеофильного присоединения к альдегиду 2.1 ( схема 2 ) с дибензилацеталем 2-бромбензальдегида 2.2 в качестве его ариллития . Этот шаг во многом схож с синтезом кольца B в общем синтезе таксола Николау, за исключением того , что альдегидная группа расположена в кольце A, а не в кольце B. Диол в 2.3 был защищен как бороновый эфир 2.4, подготавливая молекулу для замыкания верхней части кольца с тетрахлоридом олова в трицикл 2.5 в реакции, подобной фрагментации Гроба .
После снятия защиты ( пинакол ) до диола 2.6 , восстановления DIBAL до триола 2.7 и повторной защиты TBS (TBSOtf, лутидин ) до спирта 2.8 удалось удалить фенилсульфидную группу с помощью гидрида трибутилолова и AIBN (см. дезоксигенацию Бартона-МакКомби ) до спирта 2.9 . Гидрирование палладием на углероде удалило бензильную защитную группу, что позволило провести окисление по Сверну 2.10 до кетона 2.11
Завершение кольца C потребовало полного восстановления арена, размещения пара-атомов кислорода и, что важно, введения метильной группы C19. Первая атака на ароматическое кольцо в 3.1 ( схема 3 ) была начата с восстановления Берча ( калий , аммиак , тетрагидрофуран , -78 °C, затем этанол ) до диена 3.2 . Снятие защиты ( TBAF ) до диола 3.3 , повторное снятие защиты в виде ацеталя бензальдегида 3.4 и восстановление ( борогидрид натрия ) до спирта 3.5 позволило окислить диен до 1,4-бутендиола 3.6 . В этом фотохимическом [4+2] циклоприсоединении синглетный кислород был получен из кислорода и бенгальского розового , а промежуточный пероксид был восстановлен тиомочевиной . Следующим порядком дел было введение фрагмента C19: новая диольная группа была защищена как ацеталь PMP 3.7 (PMP означает п-метоксифенил ), что позволило окислить спирт C4 до кетона 3.8 с помощью периодинана Десса-Мартина . Диэтилалюминийцианид прореагировал в сопряженном присоединении к енонной группе до нитрила 3.9 . Енол был защищен как эфир TBS 3.10, что позволило восстановить нитрильную группу сначала до альдегида с помощью DIBAL , а затем до спирта 3.11 с помощью алюмогидрида лития . Спиртовая группа была заменена бромом в реакции Аппеля , что вызвало реакцию элиминирования (потерю HBr) до циклопропана 3.12 . Обработка соляной кислотой привела к образованию кетона 3.13 , реакция с иодидом самария (II) дала раскрытие кольца, в результате чего метильная группа C19 оказалась на месте в соединении 3.14 , а снятие защиты (TBAF) и превращение енол-кетон дали гидроксикетон 3.15.
Защитив диольную группу в триоле 4.1 ( схема 4 ) как фенилбороновый эфир 4.2 , оставшуюся спиртовую группу можно было защитить как эфир TBS 4.3 . После снятия защиты диольной группы ( перекись водорода , бикарбонат натрия ) снова в 4.4 стало возможным окислить спирт C19 до кетона 4.5 с помощью периодинана Десса-Мартина . В новом раунде защит спирт C7 был преобразован в 2-метокси-2-пропиловый (MOP) эфир 4.6 с помощью 2-пропенилметилового эфира и PPTS , а кетон C7 был преобразован в его енолят 4.7 реакцией с KHMDS и N,N-бис(трифторметилсульфонил)анилином . Эти преамбулы способствовали введению конечного отсутствующего фрагмента C20 в качестве реагента Гриньяра триметилсилилметилмагнийбромида , который связывался с трифлатом в катализируемой тетракис(трифенилфосфин)палладием(0) реакции с силаном 4.8 . Триметилсилильная группа устранялась при добавлении NCS к органохлориду 4.9 . Перед замыканием кольца D в кольце C были некоторые незавершенные процессы. Спирт C10 был введен путем окисления MoOPH в 4.10, но с неправильной стереохимией . После ацетилирования в 4.11 и инверсии конфигурации с добавлением основания DBN эта проблема была устранена в соединении 4.12 . Последующее дигидроксилирование с оксидом осмия (VIII) привело к образованию диола 4.13 с первичным спиртом при добавлении основания DBU, замещающего атом хлора в нуклеофильном алифатическом замещении до оксетана 4.14 .
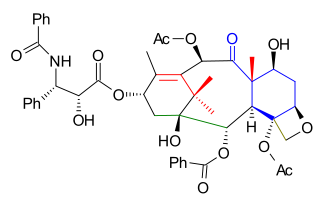
Затем были размещены функциональные группы C1, C2 и C4, и, начиная с оксетана 5.1 ( схема 5 ), защитная группа MOM удаляется в 5.2 ( PPTS ) и заменяется группой TES (TESCl) в 5.3 . Ацетальная группа удаляется в 5.4 ( гидрогенизация PdOH 2 , H 2 ) и заменяется группой карбонатного эфира в 5.5 ( трифосген , пиридин ). Третичная спиртовая группа ацетилируется в 5.6 , и на последнем этапе карбонатная группа открывается реакцией с фениллитием до гидроксиэфира 5.7 .
Перед добавлением хвоста защитная группа TES была удалена в 5.8 ( фтористый водород пиридин ) и заменена группой TROC (трихлорэтилкарбонат, TROCCl) в 5.9 . Защитная группа спирта C13 была удалена в 5.10 ( TASF ), что позволило добавить хвост лактама Ojima 5.11 (этот шаг является общим для всех общих синтетических попыток на сегодняшний день) к 5.12 с бис(триметилсилил)амидом лития . Синтез был завершен удалением TROC ( цинк , уксусная кислота ) к таксолу 5.13 .