
Презентация антигена — это жизненно важный иммунный процесс, который необходим для запуска Т-клеточного иммунного ответа. Поскольку Т-клетки распознают только фрагментированные антигены, представленные на поверхности клеток , обработка антигена должна произойти до того, как фрагмент антигена сможет быть распознан рецептором Т-клеток . В частности, фрагмент, связанный с главным комплексом гистосовместимости (MHC) , транспортируется на поверхность антигенпрезентирующей клетки – процесс, известный как презентация. Если произошла инфекция вирусами или бактериями, клеточная антигенпрезентирующая клетка будет представлять эндогенный или экзогенный пептидный фрагмент, полученный из антигена молекулами MHC. Существует два типа молекул MHC, которые различаются поведением антигенов: молекулы MHC класса I (MHC-I) связывают пептиды из цитозоля клетки , тогда как пептиды, образующиеся в эндоцитарных везикулах после интернализации, связываются с MHC класса II (MHC- I). II). [1] Клеточные мембраны разделяют эти две клеточные среды — внутриклеточную и внеклеточную. Каждая Т-клетка может распознавать только от десятков до сотен копий уникальной последовательности одного пептида среди тысяч других пептидов, представленных в той же клетке, поскольку молекула MHC в одной клетке может связываться с довольно большим спектром пептидов. [2] [3] Предсказать, какие (фрагменты) антигены будут представлены иммунной системе определенным типом MHC/HLA, сложно, но используемая технология совершенствуется. [4]

Цитотоксические Т-клетки (также известные как Т -клетки , Т-киллеры или цитотоксические Т-лимфоциты (ЦТЛ)) экспрессируют корецепторы CD8 и представляют собой популяцию Т-клеток, которые специализируются на индукции запрограммированной гибели других клеток. Цитотоксические Т-клетки регулярно патрулируют все клетки организма, поддерживая гомеостаз организма. Всякий раз, когда они сталкиваются с признаками заболевания, вызванными, например, присутствием вирусов, внутриклеточных бактерий или трансформированной опухолевой клетки, они инициируют процессы разрушения потенциально опасной клетки. [1] Все ядросодержащие клетки в организме (наряду с тромбоцитами ) содержат главный комплекс гистосовместимости I класса (молекулы MHC-I). Антигены, генерируемые эндогенно внутри этих клеток, связываются с молекулами MHC-I и представлены на поверхности клетки. Этот путь презентации антигена позволяет иммунной системе обнаруживать трансформированные или инфицированные клетки, демонстрирующие пептиды из модифицированных собственных (мутировавших) или чужеродных белков. [5] [6]
В процессе презентации эти белки в основном разлагаются на небольшие пептиды цитозольными протеазами в протеасомах , но существуют и другие цитоплазматические протеолитические пути. Затем пептиды распределяются в эндоплазматический ретикулум (ЭР) посредством действия белков теплового шока и транспортера, связанного с процессингом антигена (ТАП), который перемещает цитозольные пептиды в просвет ЭР по АТФ-зависимому механизму транспорта. Существует несколько шаперонов ER, участвующих в сборке MHC-I, таких как кальнексин , кальретикулин , Erp57, протеиндисульфид-изомераза (PDI) [7] и тапасин . В частности, комплекс TAP, тапасина, MHS класса 1, ERp57 и кальретикулина называется комплексом загрузки пептидов (PLC). [8] Пептиды загружаются в бороздку связывания пептида MHC-I между двумя альфа-спиралями в нижней части доменов α1 и α2 молекулы MHC класса I. После высвобождения тапасина комплексы пептид-MHC-I (pMHC-I) покидают ЭР и транспортируются на поверхность клетки экзоцитическими везикулами. [9] [10]
Наивные антивирусные Т-клетки ( CD8+ ) не могут напрямую уничтожать трансформированные или инфицированные клетки. Они должны быть активированы комплексами pMHC-I антигенпрезентирующих клеток (APC). Здесь антиген может быть презентирован непосредственно (как описано выше) или опосредованно ( перекрестная презентация ) из инфицированных вирусом и неинфицированных клеток. [11] После взаимодействия между pMHC-I и TCR в присутствии костимулирующих сигналов и/или цитокинов Т-клетки активируются, мигрируют в периферические ткани и убивают клетки-мишени (инфицированные или поврежденные клетки), вызывая цитотоксичность . [ нужна цитата ]
Перекрестная презентация — это особый случай, когда молекулы MHC-I способны презентировать внеклеточные антигены, обычно отображаемые только молекулами MHC-II. Эта способность проявляется у некоторых АПК, в основном у плазмоцитоидных дендритных клеток в тканях, которые непосредственно стимулируют CD8+ Т-клетки. Этот процесс важен, когда АПК не заражаются напрямую, немедленно вызывая местный противовирусный и противоопухолевый иммунный ответ без попадания АПК в местные лимфатические узлы. [6]
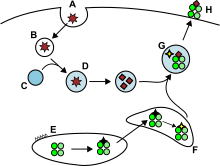
Антигены из внеклеточного пространства, а иногда и эндогенные [12] заключены в эндоцитарные везикулы и презентируются на поверхности клетки молекулами MHC-II Т-хелперам , экспрессирующим молекулу CD4 . Только APC, такие как дендритные клетки , B-клетки или макрофаги, экспрессируют молекулы MHC-II на своей поверхности в значительном количестве, поэтому экспрессия молекул MHC-II более специфична для клеток, чем MHC-I. [ нужна цитата ]
АПК обычно интернализируют экзогенные антигены путем эндоцитоза , а также путем пиноцитоза , макроаутофагии , эндосомальной микроаутофагии или шаперон-опосредованной аутофагии . [12] В первом случае после интернализации антигены заключаются в пузырьки, называемые эндосомами . В этом пути презентации антигена участвуют три компартмента: ранние эндосомы, поздние эндосомы или эндолизосомы и лизосомы , где антигены гидролизуются ассоциированными с лизосомами ферментами (кислотно-зависимыми гидролазами, гликозидазами, протеазами, липазами). Этому процессу способствует постепенное снижение pH. Основными протеазами эндосом являются катепсины , в результате чего антигены расщепляются на олигопептиды. [ нужна цитата ]
Молекулы MHC-II транспортируются из ЭР в загрузочный отсек MHC класса II вместе с инвариантной цепью белка (Ii, CD74). Неклассическая молекула MHC-II ( HLA-DO и HLA-DM ) катализирует обмен части CD74 ( пептид CLIP ) с пептидным антигеном. Комплексы пептид-MHC-II (pMHC-II) транспортируются к плазматической мембране, а процессированный антиген презентируется Т-хелперам в лимфатических узлах. [9]
АПК подвергаются процессу созревания при миграции посредством хемотаксических сигналов в лимфоидные ткани, в которых они теряют фагоцитарную способность и развивают повышенную способность связываться с Т-клетками путем презентации антигена. [13] Как и в цитотоксических Т-клетках CD8+, APC нуждаются в pMHC-II и дополнительных костимулирующих сигналах для полной активации наивных Т-хелперных клеток.
Альтернативный путь процессинга и презентации эндогенного антигена с помощью молекул MHC-II существует в медуллярных эпителиальных клетках тимуса (mTEC) посредством процесса аутофагии . Для процесса центральной толерантности Т-клеток важен, в частности, отрицательный отбор аутореактивных клонов. Случайная экспрессия генов всего генома достигается за счет действия AIRE и самопереваривания экспрессируемых молекул, представленных как на молекулах MHC-I, так и на MHC-II. [ нужна цитата ]
Рецепторы В-клеток на поверхности В-клеток связываются с интактными нативными и непереваренными антигенами структурной природы, а не с линейной последовательностью пептида, расщепленного на небольшие фрагменты и представленного молекулами MHC. Крупные комплексы интактного антигена презентируются в лимфатических узлах В-клеткам фолликулярными дендритными клетками в виде иммунных комплексов . Таким образом, некоторые АПК, экспрессирующие сравнительно более низкие уровни лизосомальных ферментов, с меньшей вероятностью переваривают захваченный ими антиген перед представлением его В-клеткам. [14] [15]