В органической химии пираноза — собирательный термин для сахаридов , которые имеют химическую структуру , включающую шестичленное кольцо , состоящее из пяти атомов углерода и одного атома кислорода ( гетероцикл ). Могут быть и другие атомы углерода, внешние по отношению к кольцу. Название происходит от его сходства с кислородным гетероциклом пираном , но пиранозное кольцо не имеет двойных связей . Пираноза, в которой аномерная −OH ( гидроксильная группа ) при C(l) была преобразована в группу OR, называется пиранозидом .
Пиранозное кольцо образуется в результате реакции гидроксильной группы на углероде 5 (C-5) сахара с альдегидом на углероде 1. Это образует внутримолекулярный полуацеталь . Если реакция происходит между гидроксилом C-4 и альдегидом, вместо этого образуется фураноза . [1] Форма пиранозы термодинамически более стабильна, чем форма фуранозы, что можно увидеть по распределению этих двух циклических форм в растворе. [2]

Герман Эмиль Фишер получил Нобелевскую премию по химии (1902) за свою работу по определению структуры D - альдогексоз . [1] Однако линейные структуры свободных альдегидов, предложенные Фишером, представляют собой очень незначительный процент форм, которые гексозные сахара принимают в растворе. Именно Эдмунд Херст и Клиффорд Первс в исследовательской группе Уолтера Хаворта окончательно определили, что гексозные сахара преимущественно образуют пиранозное, или шестичленное, кольцо. Хаворт нарисовал кольцо в виде плоского шестиугольника с группами выше и ниже плоскости кольца – проекцией Хаворта . [3]
Дальнейшее уточнение конформации пиранозных колец произошло, когда Спонслер и Доре (1926) поняли, что математическая обработка Саксом шестичленных колец может быть применена к их рентгеновской структуре целлюлозы . [3] Было установлено, что пиранозное кольцо имеет складчатую форму, что позволяет всем атомам углерода кольца иметь близкую к идеальной тетраэдрической геометрию.
Это сморщивание приводит к образованию в общей сложности 38 различных основных конформаций пиранозы : 2 стула, 6 лодок, 6 скошенных лодок, 12 полукресел и 12 конвертов. [4]

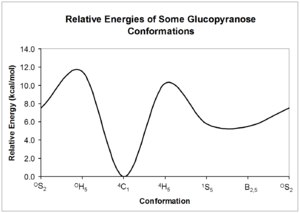
Эти конформеры могут взаимопревращаться друг с другом; однако, каждая форма может иметь очень разную относительную энергию, поэтому может присутствовать значительный барьер для взаимопревращения. Энергия этих конформаций может быть рассчитана с помощью квантовой механики ; приведен пример возможных взаимопревращений глюкопиранозы . [5]
Конформации пиранозного кольца внешне похожи на конформации циклогексанового кольца . Однако специфическая номенклатура пираноз включает ссылку на кольцевой кислород, а присутствие гидроксилов в кольце оказывает различное влияние на его конформационное предпочтение. Существуют также конформационные и стереохимические эффекты, специфичные для пиранозного кольца.

Чтобы назвать конформации пиранозы, сначала определяется конформер. Обычные конформеры похожи на те, что встречаются в циклогексане , и они составляют основу названия. Обычные конформации — кресло (C), лодка (B), скошенная (S), полукресло (H) или конверт (E). Затем атомы кольца нумеруются; аномерный , или полуацетальный, углерод всегда равен 1. Атомы кислорода в структуре, как правило, обозначаются атомом углерода, к которому они присоединены в ациклической форме, и обозначаются O. Тогда:
Как показано на диаграмме выше, относительные энергии структуры являются наиболее стабильной формой углевода. Эта относительно определенная и стабильная конформация означает, что атомы водорода пиранозного кольца удерживаются под относительно постоянными углами друг к другу. ЯМР углеводов использует эти двугранные углы для определения конфигурации каждой из гидроксильных групп вокруг кольца.