Мозговое кровообращение — это движение крови через сеть мозговых артерий и вен , снабжающих мозг . Скорость мозгового кровотока у взрослого человека обычно составляет 750 миллилитров в минуту , или около 15% сердечного выброса . Артерии доставляют насыщенную кислородом кровь, глюкозу и другие питательные вещества в мозг. Вены переносят «использованную или потраченную» кровь обратно в сердце , чтобы удалить углекислый газ , молочную кислоту и другие продукты метаболизма . Нейроваскулярный блок регулирует мозговой кровоток, чтобы активированные нейроны могли снабжаться энергией в нужном количестве и в нужное время. [1] Поскольку мозг быстро пострадает от любой остановки кровоснабжения, система мозгового кровообращения имеет меры безопасности, включая саморегуляцию кровеносных сосудов . Отказ от этих мер безопасности может привести к инсульту . Объем циркулирующей крови называется мозговым кровотоком. Внезапные интенсивные ускорения изменяют гравитационные силы, воспринимаемые телами, и могут серьезно ухудшить мозговое кровообращение и нормальные функции до такой степени, что это станет серьезным опасным для жизни состоянием.
Следующее описание основано на идеализированном мозговом кровообращении человека. Модель кровообращения и его номенклатура различаются у разных организмов.

Кровоснабжение мозга обычно делится на передний и задний сегменты, относящиеся к различным артериям, которые снабжают мозг. Две основные пары артерий — это внутренние сонные артерии (снабжают передний мозг) и позвоночные артерии (снабжают ствол мозга и задний мозг). [2] Передний и задний мозговой кровоток связаны между собой посредством двусторонних задних соединительных артерий . Они являются частью Виллизиева круга , который обеспечивает резервное кровообращение мозга. В случае окклюзии одной из питающих артерий Виллизиевый круг обеспечивает взаимосвязь между передним и задним мозговым кровообращением вдоль пола свода мозга, обеспечивая кровью ткани, которые в противном случае стали бы ишемическими . [3]

Передний мозговой кровоток — это кровоснабжение передней части мозга, включая глаза . Он снабжается следующими артериями:
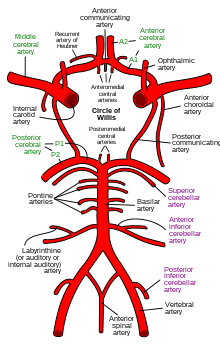
Заднее мозговое кровообращение — это кровоснабжение задней части мозга, включая затылочные доли , мозжечок и ствол мозга . Оно снабжается следующими артериями:
Венозный отток от головного мозга можно разделить на два отдела: поверхностный и глубокий.
Поверхностная система состоит из дуральных венозных синусов , синусов (каналов) внутри твердой мозговой оболочки . Таким образом, дуральные синусы расположены на поверхности головного мозга. Наиболее заметным из этих синусов является верхний сагиттальный синус , который расположен в сагиттальной плоскости под средней линией свода мозга, сзади и ниже слияния синусов , где поверхностный дренаж соединяется с синусом, который в первую очередь дренирует глубокую венозную систему. Отсюда два поперечных синуса разветвляются и идут латерально и вниз по S-образной кривой, которая образует сигмовидные синусы , которые продолжают формировать две яремные вены . На шее яремные вены параллельны восходящему ходу сонных артерий и дренируют кровь в верхнюю полую вену . Вены прокалывают соответствующий дуральный синус, пронизывая паутинную и твердую мозговую оболочку, образуя мостовые вены , которые отводят свое содержимое в синус. [5]
Глубокая венозная система в основном состоит из традиционных вен внутри глубоких структур мозга, которые соединяются позади среднего мозга, образуя большую мозговую вену (вену Галена). Эта вена сливается с нижним сагиттальным синусом , образуя прямой синус , который затем присоединяется к поверхностной венозной системе, упомянутой выше, в месте слияния синусов .
Созревание кровеносных сосудов в мозге является критическим процессом , который происходит после рождения. [6] Он включает приобретение ключевых барьерных и сократительных свойств, необходимых для функционирования мозга. В течение ранней постнатальной фазы эндотелиальные клетки (ЭК) и сосудистые гладкомышечные клетки (ВГМК) претерпевают значительные молекулярные и функциональные изменения.
Эндотелиальные клетки начинают экспрессировать P-гликопротеин , важный транспортер эффлюкса , который помогает защищать мозг, вытесняя вредные вещества. [7] Эта способность к эффлюксу постепенно приобретается и становится полностью функциональной к постнатальному периоду. Кроме того, VSMC, которые изначально заселяют артериальную сеть, начинают экспрессировать сократительные белки, такие как гладкомышечный актин (SMA) и миозин-11 , превращая VSMC в сократительные клетки, способные регулировать тонус кровеносных сосудов и мозговой кровоток.
Экспрессия Myh11 в гладкомышечных клетках сосудов действует как переключатель развития, при этом значительная регуляция происходит от рождения до возраста 2–5 лет. [6] Это критический период, необходимый для установления сократимости сосудов и общей функциональности мозгового кровообращения.

Мозговой кровоток (МК) — это кровоснабжение мозга в определенный период времени. [8] У взрослого человека МК обычно составляет 750 миллилитров в минуту или 15,8 ± 5,7% от сердечного выброса . [9] Это соответствует средней перфузии от 50 до 54 миллилитров крови на 100 граммов мозговой ткани в минуту. [10] [11] [12]
Радиоиндекс мозгового кровотока/сердечного выброса (CCRI) уменьшается на 1,3% за десятилетие, хотя сердечный выброс остается неизменным. [9] На протяжении всей взрослой жизни женщины имеют более высокий CCRI, чем мужчины. [9] CBF обратно пропорционально связан с индексом массы тела . [9]
CBF строго регулируется для удовлетворения метаболических потребностей мозга . [10] [13] Слишком много крови (клиническое состояние нормальной гомеостатической реакции гиперемии ) [1] может повысить внутричерепное давление (ВЧД), что может сдавливать и повреждать нежную мозговую ткань. Слишком малый кровоток ( ишемия ) возникает, если приток крови к мозгу ниже 18–20 мл на 100 г в минуту, и отмирание ткани происходит, если поток падает ниже 8–10 мл на 100 г в минуту. В мозговой ткани биохимический каскад , известный как ишемический каскад, запускается, когда ткань становится ишемической, что потенциально приводит к повреждению и гибели клеток мозга . Медицинские специалисты должны принимать меры для поддержания надлежащего CBF у пациентов с такими состояниями, как шок , инсульт , отек мозга и черепно-мозговая травма .
Церебральный кровоток определяется рядом факторов, таких как вязкость крови, степень расширения кровеносных сосудов и чистое давление потока крови в мозг, известное как церебральное перфузионное давление , которое определяется кровяным давлением организма . Церебральное перфузионное давление (ЦПД) определяется как среднее артериальное давление (САД) за вычетом внутричерепного давления (ВЧД). У здоровых людей оно должно быть выше 50 мм рт. ст. Внутричерепное давление не должно превышать 15 мм рт. ст. (ВЧД 20 мм рт. ст. считается внутричерепной гипертензией). [14] Церебральные кровеносные сосуды способны изменять поток крови через них, изменяя свой диаметр в процессе, называемом церебральной ауторегуляцией ; они сужаются, когда системное артериальное давление повышается, и расширяются, когда оно понижается. [15] Артериолы также сужаются и расширяются в ответ на различные химические концентрации. Например, они расширяются в ответ на более высокий уровень углекислого газа в крови и сужаются в ответ на более низкий уровень углекислого газа. [15]
Например, предположим, что у человека парциальное давление углекислого газа в артериальной крови ( PaCO2 ) составляет 40 мм рт. ст. (нормальный диапазон 38–42 мм рт. ст.) [16] и CBF составляет 50 мл на 100 г в минуту. Если PaCO2 падает до 30 мм рт. ст., это представляет собой снижение на 10 мм рт. ст. от начального значения PaCO2. Следовательно, CBF уменьшается на 1 мл на 100 г в минуту для каждого снижения PaCO2 на 1 мм рт. ст., что приводит к новому CBF в 40 мл на 100 г мозговой ткани в минуту. Фактически, для каждого увеличения или уменьшения PaCO2 на 1 мм рт. ст. в диапазоне 20–60 мм рт. ст. происходит соответствующее изменение CBF в том же направлении приблизительно на 1–2 мл/100 г/мин или на 2–5% от значения CBF. [17] Вот почему небольшие изменения в характере дыхания могут вызвать значительные изменения в глобальном кровотоке, особенно за счет изменений PaCO2. [17]
CBF равен давлению церебральной перфузии (CPP), деленному на цереброваскулярное сопротивление (CVR): [18]
Контроль CBF рассматривается с точки зрения факторов, влияющих на CPP, и факторов, влияющих на CVR. CVR контролируется четырьмя основными механизмами:
Повышенное внутричерепное давление (ВЧД) вызывает снижение перфузии клеток мозга кровью в основном за счет двух механизмов:
Давление церебральной перфузии — это чистый градиент давления , вызывающий приток церебральной крови к мозгу ( перфузия мозга ). Его необходимо поддерживать в узких пределах; слишком низкое давление может привести к ишемии мозговой ткани ( недостаточному притоку крови), а слишком высокое может повысить внутричерепное давление .
Артериальная спиновая маркировка (ASL), фазово-контрастная магнитно-резонансная томография (PC-MRI) и позитронно-эмиссионная томография (ПЭТ) — это методы нейровизуализации , которые можно использовать для измерения CBF. ASL и ПЭТ также можно использовать для измерения регионального CBF (rCBF) в определенной области мозга. rCBF в одном месте можно измерить с течением времени с помощью термодиффузии [19]