Структурная биология , как ее определяет Журнал структурной биологии , занимается структурным анализом живого материала (образованного, состоящего из живых клеток и/или поддерживаемого и совершенствуемого ими) на каждом уровне организации. [1]
Ранние структурные биологи на протяжении 19-го и начала 20-го веков в основном могли изучать структуры только на пределе остроты зрения невооруженного глаза и через увеличительные стекла и световые микроскопы. В 20-м веке были разработаны различные экспериментальные методы для изучения трехмерных структур биологических молекул. Наиболее известными методами являются рентгеновская кристаллография , ядерный магнитный резонанс и электронная микроскопия . Благодаря открытию рентгеновских лучей и их применению к кристаллам белков структурная биология была революционизирована, поскольку теперь ученые могли получать трехмерные структуры биологических молекул в атомных деталях. [2] Аналогичным образом, ЯМР-спектроскопия позволила получить информацию о структуре и динамике белков. [3] Наконец, в 21 веке электронная микроскопия также пережила радикальную революцию с разработкой более когерентных источников электронов, коррекции аберраций для электронных микроскопов и программного обеспечения для реконструкции, которое позволило успешно реализовать криоэлектронную микроскопию высокого разрешения, тем самым позволив изучать отдельные белки и молекулярные комплексы в трех измерениях с разрешением в несколько ангстрем.
С развитием этих трех методов область структурной биологии расширилась и также стала разделом молекулярной биологии , биохимии и биофизики, занимающимся молекулярной структурой биологических макромолекул (особенно белков , состоящих из аминокислот , РНК или ДНК , состоящих из нуклеотидов , и мембран , состоящих из липидов ), тем, как они приобретают имеющиеся у них структуры, и как изменения в их структурах влияют на их функции. [4] Эта тема представляет большой интерес для биологов, поскольку макромолекулы выполняют большинство функций клеток , и только сворачиваясь в определенные трехмерные формы, они способны выполнять эти функции. Эта архитектура, « третичная структура » молекул, сложным образом зависит от основного состава каждой молекулы, или « первичной структуры ». При более низком разрешении такие инструменты, как FIB-SEM томография, позволили лучше понять клетки и их органеллы в 3-х измерениях, а также то, как каждый иерархический уровень различных внеклеточных матриц вносит вклад в функцию (например, в костях). В последние несколько лет также стало возможным предсказывать высокоточные физические молекулярные модели для дополнения экспериментального изучения биологических структур. [5] Вычислительные методы, такие как моделирование молекулярной динамики , могут использоваться в сочетании со стратегиями эмпирического определения структуры для расширения и изучения структуры, конформации и функции белка. [6]


В 1912 году Макс фон Лауэ направил рентгеновские лучи на кристаллизованный сульфат меди, создав дифракционную картину . [7] Эти эксперименты привели к развитию рентгеновской кристаллографии и ее использованию в исследовании биологических структур. [5] В 1951 году Розалинд Франклин и Морис Уилкинс использовали рентгеновские дифракционные картины для получения первого изображения дезоксирибонуклеиновой кислоты (ДНК). Фрэнсис Крик и Джеймс Уотсон смоделировали двойную спиральную структуру ДНК, используя эту же технику в 1953 году, и получили Нобелевскую премию по медицине вместе с Уилкинсом в 1962 году. [8]
Кристаллы пепсина были первыми белками, которые были кристаллизованы для использования в рентгеновской дифракции Теодором Сведбергом , получившим Нобелевскую премию по химии 1962 года. [9] Первая третичная структура белка , структура миоглобина , была опубликована в 1958 году Джоном Кендрю . [10] В то время моделирование структур белков проводилось с использованием моделей из бальзового дерева или проволоки . [11] С изобретением программного обеспечения для моделирования, такого как CCP4, в конце 1970-х годов, [12] моделирование теперь выполняется с помощью компьютера. Последние разработки в этой области включают создание рентгеновских лазеров на свободных электронах , позволяющих анализировать динамику и движение биологических молекул, [13] и использование структурной биологии в оказании помощи синтетической биологии . [14]
В конце 1930-х и начале 1940-х годов сочетание работ, проделанных Исидором Раби , Феликсом Блохом и Эдвардом Миллсом Перселлом , привело к развитию ядерного магнитного резонанса (ЯМР). В настоящее время ЯМР твердого тела широко используется в области структурной биологии для определения структуры и динамической природы белков ( белковый ЯМР ). [15]
В 1990 году Ричард Хендерсон получил первое трехмерное изображение бактериородопсина с высоким разрешением, используя криогенную электронную микроскопию (крио-ЭМ). [16] С тех пор крио-ЭМ стала все более популярной технологией определения трехмерных структур с высоким разрешением на биологических изображениях. [17]
Совсем недавно были разработаны вычислительные методы для моделирования и изучения биологических структур. Например, молекулярная динамика (МД) обычно используется для анализа динамических движений биологических молекул. В 1975 году в журнале Nature была опубликована первая симуляция биологического процесса сворачивания с использованием МД. [18] Недавно предсказание структуры белка было значительно улучшено новым методом машинного обучения под названием AlphaFold. [19] Некоторые утверждают, что вычислительные подходы начинают лидировать в области исследований структурной биологии. [20]
Биомолекулы слишком малы, чтобы рассмотреть их в деталях даже с помощью самых современных световых микроскопов . Методы, которые структурные биологи используют для определения их структур, обычно включают измерения огромного количества идентичных молекул одновременно. Эти методы включают:
Чаще всего исследователи используют их для изучения « нативных состояний » макромолекул. Но вариации этих методов также используются для наблюдения за тем, как зарождающиеся или денатурированные молекулы принимают или повторно принимают свои нативные состояния. См. сворачивание белка .
Третий подход, который структурные биологи используют для понимания структуры, — это биоинформатика , которая ищет закономерности среди разнообразных последовательностей , которые приводят к определенным формам. Исследователи часто могут вывести аспекты структуры интегральных мембранных белков на основе топологии мембраны, предсказанной с помощью анализа гидрофобности . См. прогнозирование структуры белка .
Структурные биологи внесли значительный вклад в понимание молекулярных компонентов и механизмов, лежащих в основе заболеваний человека. Например, крио-ЭМ и ssNMR использовались для изучения агрегации амилоидных фибрилл, которые связаны с болезнью Альцгеймера , болезнью Паркинсона и диабетом II типа . [21] В дополнение к амилоидным белкам ученые использовали крио-ЭМ для создания моделей высокого разрешения тау-нитей в мозге пациентов с болезнью Альцгеймера, которые могут помочь в разработке более эффективных методов лечения в будущем. [22] Инструменты структурной биологии также могут быть использованы для объяснения взаимодействия между патогенами и хозяевами. Например, инструменты структурной биологии позволили вирусологам понять, как оболочка ВИЧ позволяет вирусу обходить иммунные реакции человека. [23]
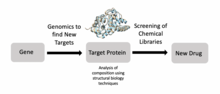
Структурная биология также является важным компонентом открытия лекарств . [24] Ученые могут идентифицировать цели с помощью геномики, изучать эти цели с помощью структурной биологии и разрабатывать лекарства, которые подходят для этих целей. В частности, лиганд- ЯМР , масс-спектрометрия и рентгеновская кристаллография являются широко используемыми методами в процессе открытия лекарств. Например, исследователи использовали структурную биологию, чтобы лучше понять Met , белок, кодируемый протоонкогеном, который является важной целью лекарств при раке . [25] Аналогичные исследования были проведены для целей ВИЧ для лечения людей со СПИДом . [24] Исследователи также разрабатывают новые противомикробные препараты для микобактериальных инфекций, используя структурно-ориентированное открытие лекарств. [24]
{{cite web}}: CS1 maint: bot: original URL status unknown (link)