
Теория столкновений — это принцип химии, используемый для прогнозирования скоростей химических реакций . Он гласит, что когда подходящие частицы реагента сталкиваются друг с другом с правильной ориентацией, только определенное количество столкновений приводит к ощутимому или заметному изменению; эти успешные изменения называются успешными столкновениями. Успешные столкновения должны иметь достаточно энергии, также известной как энергия активации , в момент удара, чтобы разорвать уже существующие связи и образовать все новые связи. Это приводит к продуктам реакции. Энергия активации часто предсказывается с помощью теории переходного состояния . Увеличение концентрации реагента приводит к большему количеству столкновений и, следовательно, к большему количеству успешных столкновений. Повышение температуры увеличивает среднюю кинетическую энергию молекул в растворе, увеличивая число столкновений, которые имеют достаточно энергии. Теория столкновений была предложена независимо Максом Траутцем в 1916 году [1] и Уильямом Льюисом в 1918 году. [2] [3]
Когда в столкновении между молекулами реагентов участвует катализатор, для осуществления химического изменения требуется меньше энергии, и, следовательно, больше столкновений имеют достаточно энергии для осуществления реакции. Скорость реакции, таким образом, увеличивается.
Теория столкновений тесно связана с химической кинетикой .
Теория столкновений изначально была разработана для системы газовых реакций без разбавления. Но большинство реакций включают растворы, например, газовые реакции в несущем инертном газе и почти все реакции в растворах. Частота столкновений молекул растворенного вещества в этих растворах теперь контролируется диффузией или броуновским движением отдельных молекул. Поток диффузионных молекул следует законам диффузии Фика . Для частиц в растворе примером модели для расчета частоты столкновений и связанной с ними скорости коагуляции является уравнение коагуляции Смолуховского, предложенное Марианом Смолуховским в основополагающей публикации 1916 года. [4] В этой модели поток Фика на бесконечном временном пределе используется для имитации скорости частиц теории столкновений. Цзисинь Чен предложил конечное временное решение для диффузионного потока в 2022 году, которое существенно изменяет расчетную частоту столкновений двух частиц в растворе. [5]
Скорость бимолекулярной газофазной реакции A + B → продукт, предсказанная теорией столкновений, равна [6]
где:
Единицу измерения r ( T ) можно преобразовать в моль⋅л −1 ⋅с −1 , разделив на (1000× N A ), где N A — постоянная Авогадро .
Для реакции между A и B частота столкновений , рассчитанная с помощью модели твердых сфер с единичным числом столкновений на м 3 в секунду, составляет:
где:
Если все единицы , связанные с размерностью, перевести в дм, т.е. моль⋅дм −3 для [A] и [B], дм2 для σAB , дм2 ⋅кг⋅с −2 ⋅К − 1 для постоянной Больцмана , то
единица моль⋅дм −3 ⋅с −1 .
Рассмотрим бимолекулярную элементарную реакцию:
В теории столкновений считается, что две частицы A и B столкнутся, если их ядра сблизятся больше, чем на определенное расстояние. Площадь вокруг молекулы A, в которой она может столкнуться с приближающейся молекулой B, называется поперечным сечением (σ AB ) реакции и, упрощенно говоря, представляет собой площадь, соответствующую окружности, радиус которой ( ) является суммой радиусов обеих реагирующих молекул, которые предположительно являются сферическими. Таким образом, движущаяся молекула будет охватывать объем в секунду при своем движении, где - средняя скорость частицы. (Это представляет собой исключительно классическое представление о столкновении твердых шаров. Поскольку молекулы представляют собой квантово-механические многочастичные системы электронов и ядер, основанные на кулоновских и обменных взаимодействиях, они, как правило, не подчиняются вращательной симметрии и не имеют потенциала ящика. Поэтому, в более общем смысле, поперечное сечение определяется как вероятность реакции луча частиц A на поверхностную плотность мишеней B, что делает определение независимым от характера взаимодействия между A и B. Следовательно, радиус связан с масштабом длины их потенциала взаимодействия.)
Из кинетической теории известно, что молекула А имеет среднюю скорость (отличную от среднеквадратичной скорости) , где — постоянная Больцмана , а — масса молекулы.
Решение задачи двух тел гласит, что два различных движущихся тела можно рассматривать как одно тело, которое имеет приведенную массу обоих и движется со скоростью центра масс , поэтому в этой системе следует использовать вместо . Таким образом, для данной молекулы A она движется до столкновения с молекулой B, если все B зафиксированы без движения, где — среднее расстояние перемещения. Поскольку B также движется, относительную скорость можно вычислить, используя приведенную массу A и B.
Следовательно, общая частота столкновений [8] всех молекул A со всеми молекулами B равна
Из распределения Максвелла-Больцмана можно вывести, что доля столкновений с энергией, большей энергии активации, равна . Таким образом, скорость бимолекулярной реакции для идеальных газов будет равна
где:
Произведение zρ эквивалентно предэкспоненциальному множителю уравнения Аррениуса .
После формулирования теории ее обоснованность необходимо проверить, то есть сравнить ее предсказания с результатами экспериментов.
Если сравнить форму выражения константы скорости с уравнением скорости элементарной бимолекулярной реакции, то можно заметить, что
единица М −1 ⋅с −1 (= дм 3 ⋅моль −1 ⋅с −1 ), со всеми единицами размерности дм, включая k B .
Это выражение похоже на уравнение Аррениуса и дает первое теоретическое объяснение уравнения Аррениуса на молекулярной основе. Слабая температурная зависимость предэкспоненциального множителя настолько мала по сравнению с экспоненциальным множителем, что ее невозможно измерить экспериментально, то есть «невозможно установить на основе температурных исследований константы скорости, является ли предсказанное значение T 1/2 зависимость предэкспоненциального множителя наблюдается экспериментально». [9]
Если значения предсказанных констант скорости сравниваются со значениями известных констант скорости, то можно заметить, что теория столкновений не может правильно оценить константы, и чем сложнее молекулы, тем больше она не может. Причина этого в том, что частицы предполагались сферическими и способными реагировать во всех направлениях, что неверно, так как ориентация столкновений не всегда соответствует реакции. Например, в реакции гидрирования этилена молекула H2 должна приблизиться к зоне связи между атомами, и только несколько из всех возможных столкновений удовлетворяют этому требованию.
Чтобы решить эту проблему, необходимо ввести новое понятие: стерический фактор ρ . Он определяется как отношение экспериментального значения к предсказанному (или отношение частотного фактора к частоте столкновений):
и чаще всего он меньше единицы. [7]
Обычно, чем сложнее молекулы реагентов, тем ниже стерический фактор. Тем не менее, некоторые реакции демонстрируют стерические факторы больше единицы: реакции гарпуна , в которых участвуют атомы, обменивающиеся электронами , производя ионы . Отклонение от единицы может иметь разные причины: молекулы не сферические, поэтому возможны разные геометрии; не вся кинетическая энергия доставляется в нужное место; присутствие растворителя (при применении к растворам) и т. д.
Теория столкновений может быть применена к реакциям в растворе; в этом случае клетка растворителя оказывает влияние на молекулы реагентов, и несколько столкновений могут происходить в одной столкновении, что приводит к тому, что предсказанные предэкспоненциальные множители оказываются слишком большими. Значения ρ больше единицы можно отнести к благоприятным энтропийным вкладам.
Столкновения в разбавленном газе или жидком растворе регулируются диффузией вместо прямых столкновений, которые можно рассчитать с помощью законов диффузии Фика . Теоретические модели для расчета частоты столкновений в растворах были предложены Марианом Смолуховским в основополагающей публикации 1916 года при бесконечном пределе времени [4] и Цзисинем Ченом в 2022 году при приближении конечного времени [5] . Схема сравнения уравнений скорости в чистом газе и растворе показана на правом рисунке.
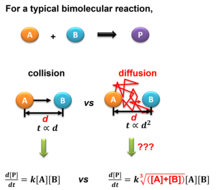
Для разбавленного раствора в газовой или жидкой фазе уравнение столкновения, разработанное для чистого газа, не подходит, когда диффузия берет под контроль частоту столкновений, т. е. прямое столкновение между двумя молекулами больше не доминирует. Для любой данной молекулы A она должна столкнуться со множеством молекул растворителя, скажем, молекулой C, прежде чем найти молекулу B для реакции. Таким образом, вероятность столкновения следует рассчитывать с использованием модели броуновского движения , которую можно аппроксимировать диффузионным потоком с использованием различных граничных условий, которые дают различные уравнения в модели Смолуховского и модели JChen.
Для диффузионного столкновения, в пределе бесконечного времени, когда молекулярный поток можно рассчитать с помощью законов диффузии Фика , в 1916 году Смолуховский вывел частоту столкновений между молекулами A и B в разбавленном растворе: [4]
где:
или
где:
С момента предложения модели Смолуховского в 1916 году ее подвергли множеству расширений и модификаций.
В 2022 году Чен рассуждает о том, что поскольку диффузионный поток развивается с течением времени, а расстояние между молекулами имеет конечное значение при данной концентрации, должно быть критическое время для прекращения эволюции потока, что даст значение, намного большее, чем бесконечное решение, предложенное Смолуховским. [5] Поэтому он предлагает использовать среднее время для двух молекул, чтобы поменяться местами в растворе, в качестве критического времени прекращения, т. е. время посещения первого соседа. Хотя альтернативным временем может быть среднее время свободного пробега или среднее время первого пассажира, оно переоценивает градиент концентрации между исходным местоположением первого пассажира и целью. Эта гипотеза дает фрактальное уравнение кинетической скорости реакции диффузионного столкновения в разбавленном растворе: [5]
где: